全球首款KRAS抑制剂获批
5月29日,美国FDA加速批准安进(Amgen)公司新药Sotorasib上市,用于治疗携带KRAS G12C突变的既往至少接受过一次系统治疗的局部晚期或转移性非小细胞肺癌(NSCLC)患者,这是首款靶向KRAS蛋白的抗肿瘤药物。(自FDA)
研究数据
Sotorasib获批是基于Ⅱ期CodeBreaK100临床试验(NCT03600883)中患者亚群结果。该研究亚群包括124例接受免疫治疗和/或化疗后出现疾病进展的携带KRAS G12C突变局部晚期或转移性NSCLC患者,所有患者口服Sotorasib 960 mg qd,直到疾病进展。主要研究终点为客观缓解率和缓解持续时间。研究结果显示,Sotorasib治疗的ORR达36%,疾病控制率达81%,中位缓解持续时间为10个月,58%的患者缓解持续时间≥6个月。
探索性分析结果显示,在一系列生物标志物亚组中观察到Sotorasib的临床活性,包括PD-L1表达阴性或水平低的亚组和STK11突变的亚组。
Sotorasib最常见的不良事件包括腹泻、肌肉骨骼疼痛、恶心、疲劳、肝损伤和咳嗽。根据FDA 的规定,如果患者出现间质性肺病的症状,应停用该药物;如果确诊为间质性肺病,则应永久停用该药物。在治疗开始前应监测患者肝功能,如果出现肝损伤,应停用Sotorasib、减少剂量或永久停药。
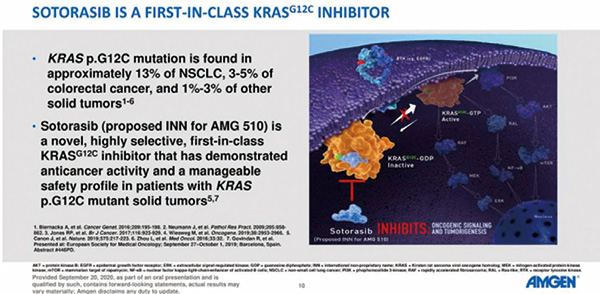
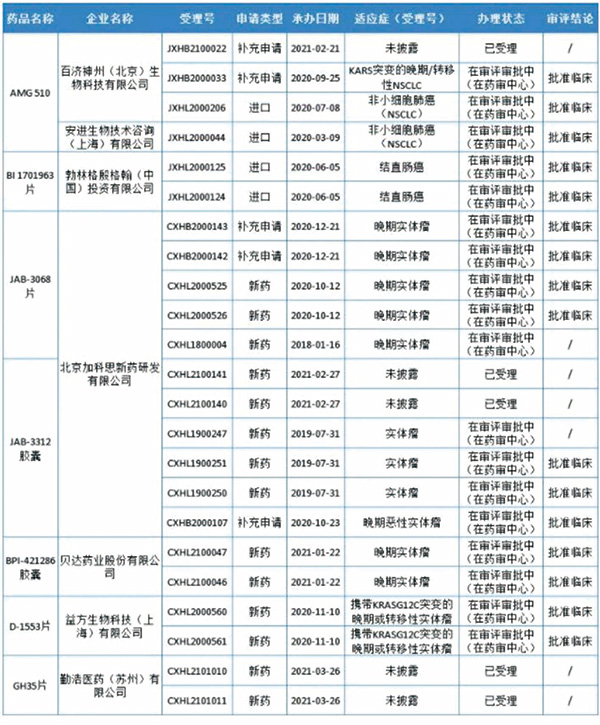
Sotorasib(Lumakras,AMG510)是由安进公司开发的一款“first-in-class”的KRA SG12C突变体抑制剂,首个进入临床的KRAS G12C抑制剂。2020年12月10日,FDA授予Sotorasib(AMG 510)突破性药物资格(BTD)和实时肿瘤学审查资格(RTOR)。2020年12月16日,安进(Amgen)公司宣布向美国FDA提交新药申请(NDA),用于治疗携带KRAS G12C突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者,距离获批上市仅6个月。
关于KRAS
长期以来,KRAS一直被认为难以成药的靶标:1)KRAS作为GTP酶,与GTP的结合亲和力高达皮摩尔级别;2)KRAS的底物GTP在细胞内的浓度很高;3)KRAS蛋白表面非常平滑,除GTP结合位点外,难以找到其他小分子结合口袋。
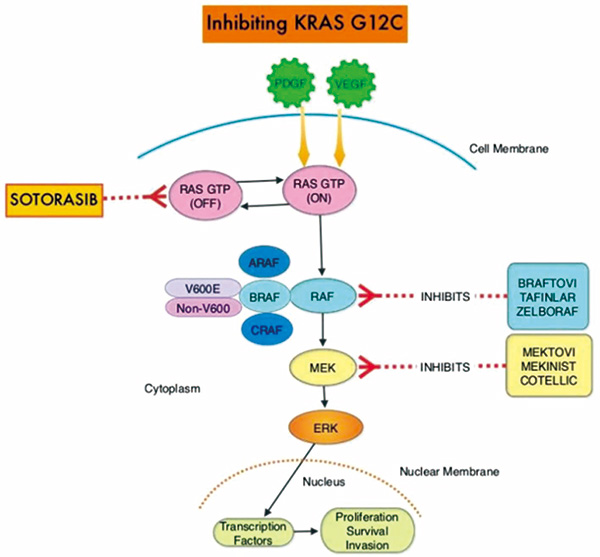
2013年Nature上首次发表KRAS G12C的小分子共价靶向策略,针对KRAS突变小分子抑制剂的研究才真正取得显著进展。研究发现当KRAS G12C蛋白与GDP结合时,失活状态的KRAS蛋白表面出现一个新的由SwitchⅡ参与组成的结合口袋,即S-ⅡP变构结合位点。

KRAS(G12C)突变蛋白的第12位甘氨酸(Glycine)位点突变成易与共价抑制剂结合的半胱氨酸(Cysteine),从而将KRAS(G12C)锁死在失活状态下。大多数KRAS错义突变发生在12号密码子中,约占KRAS所有突变的70%,其中G12D突变最为常见(33.6%),G12V次之(23.0%),G12C约占11.4%。KRAS G12D/G12V突变在90%的胰腺癌中均有发现,是胰腺癌的重要潜在治疗靶标。KRAS G12D是结肠癌中最常见的KRAS突变形式。
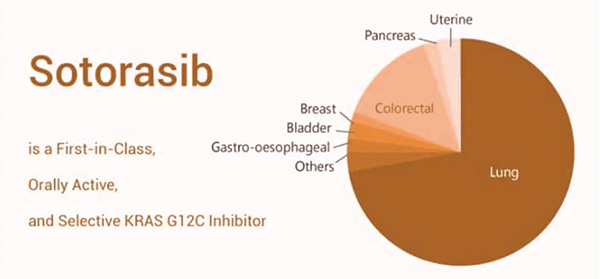
KRAS G12C突变是多种癌症的驱动基因,约13%的肺癌和3%的结肠癌中存在该突变。对于存在KRAS突变的NSCLC患者而言,由于KRAS突变状态不受上游EGFR基因的影响,只有野生型KRAS基因受到上游EGFR基因的影响,因此EGFR靶向药物对他们的治疗并无效果。KRAS抑制剂对肺癌等肿瘤具有潜在治疗作用。


