三阴性乳腺癌 复旦分型指导精准一线治疗研究发表
复旦大学附属肿瘤医院邵志敏教授等报告的多队列、随机、Ⅱ期试验(FUTURE-SUPER)强调了在三阴性乳腺癌患者中使用基于分子亚型的优化治疗的潜在临床益处,为进一步的临床研究提供了途径。旨在评估基于亚型的方案疗效的Ⅲ期随机临床试验目前正在进行中。(Lancet Oncol. 2024年1月8日在线版)
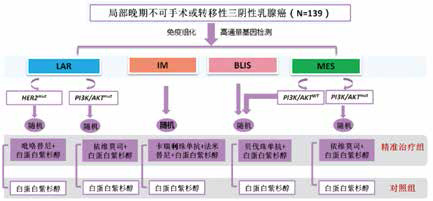
三阴性乳腺癌在分子驱动和免疫特性上表现出异质性。邵教授等之前将三阴性乳腺癌分为四种亚型:Luminal雄激素受体(LAR)亚型、免疫调节性亚型、基底样免疫抑制(BLIS)亚型和间充质样(MES)亚型。该研究的目的是评估基于亚型的一线治疗三阴性乳腺癌的疗效和安全性。
FUTURE-SUPER是一项正在进行的、开放标签的、随机对照Ⅱ期临床试验,正在复旦大学上海癌症中心进行。符合条件的参与者是年龄为18~70岁的女性,ECOG PS评分为0~1,组织学证实的未经治疗的转移性或复发性三阴性乳腺癌。
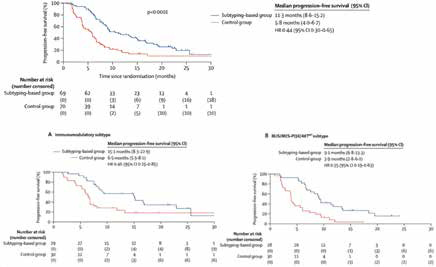
根据分子亚型和基因组生物标志物被分为5个队列后,参与者被随机等比分配,按亚型分层,28天为一个周期,单独接受白蛋白型紫杉醇(100 mg/m2,d1、8、15,iv;对照组)或基于亚型的方案(基于亚型组)。
基于亚型组的方案为用于治疗LAR-HER2mut亚型的吡咯替尼(400 mg qd Po),用于治疗LAR-PI3K/AKTmut和MES-PI3K/AKTmut亚型的依维莫司(10 mg qd Po),用于治疗免疫调节亚型的卡瑞利珠单抗(200 mg d1、15 iv)和法米替尼(20 mg qd Po),以及用于治疗BLIS/MES-PI3K/AKTWT亚型的贝伐珠单抗(10 mg/kg d1、15 iv)。
主要终点是研究人员在合并的基于亚型组与意向治疗人群(所有随机分配的参与者)的对照组中评估的无进展生存期。对所有接受至少一剂研究药物且有安全记录的患者进行安全性分析。
2020年7月28日至2022年10月16日,139例女性参与者被入组,并随机分配到基于亚型组(69例)或对照组(70例)。截至数据截止日期(2023年5月31日),中位随访时间为22.5个月(IQR:15.2~29.0个月)。合并亚型组的中位无进展生存期(11.3个月,95%CI 8.6~15.2个月)明显长于对照组(5.8个月,95%CI 4.0 ~6.7个月;HR=0.44,95%CI 0.30~0.65,P<0.0001)。
最常见的3~4级治疗相关不良事件是中性粒细胞减少症(合并亚型组30%,对照组23%)、贫血(7% vs. 0)和丙氨酸转氨酶升高(6% vs. 1%)。在基于亚型的组中,69例患者中有7例(10%)报告了与治疗相关的严重不良事件,而对照组中没有。两组均无治疗相关死亡报告。
链接
吡咯替尼是恒瑞医药自主研发并拥有知识产权的口服HER1、HER2、HER4酪氨酸激酶抑制剂(TKI),也是在中国实体瘤领域首个凭借Ⅱ期临床研究有条件批准上市的1.1类创新药,随后多项Ⅲ期研究也充分证明了吡咯替尼能够为HER2阳性乳腺癌患者带来获益。在FUTURE-SUPER研究HER2突变队列中吡咯替尼联合白蛋白结合型紫杉醇显示出具有潜力的疗效。卡瑞利珠单抗是恒瑞医药自主研发并拥有知识产权的人源化PD-1单克隆抗体,2019年5月获批上市以来,已在肺癌、肝癌、食管癌、鼻咽癌以及淋巴瘤五大瘤种中获批9个适应证。法米替尼同样是恒瑞自主研发的小分子多靶点酪氨酸激酶抑制剂,法米替尼新药上市申请以及卡瑞利珠单抗新适应证上市申请均获受理,本次申报适应证为卡瑞利珠单抗联合法米替尼二线治疗宫颈癌,该适应证已被CDE纳入突破性疗法。在FUTURE-SUPER研究IM亚型中卡瑞利珠单抗联合法米替尼和白蛋白结合型紫杉醇的PFS获益幅度最大,与FUTURE-C-PLUS研究相辅相成,共同助力此治疗组合在mTNBC的应用。 (编译 何慧芳)














