FDA批准capivasertib联合氟维司群新乳腺癌适应证
发布时间:2024-11-26
点击量:
美国食品和药物管理局(FDA)批准capivasertib联合氟维司群用于激素受体阳性、人表皮生长因子受体2(HER2)阴性、局部晚期或转移性乳腺癌(MBC)的成人患者,这些患者既往接受过至少一种内分泌治疗,且伴有一种或多种磷脂酰肌醇3-激酶(PIK3CA)/AKT丝氨酸/苏氨酸激酶1(AKT1)/磷酸酶张力蛋白同源物(PTEN)改变。(J Clin Oncol. 2024年8月19日在线版)
该批准基于一项随机、双盲、多中心试验CAPItello-291,该试验入组708例激素受体阳性,HER2阴性晚期或MBC患者,包括289例PIK3CA/AKT1/PTEN肿瘤改变患者。患者被按照1∶1的比例被随机分配接受capivasertib 400 mg,每日两次,每周4天,与氟维司群联合使用,或安慰剂联合氟维司群;并根据肝转移的、既往细胞周期蛋白依赖性激酶4和6抑制剂(CDK4/6i)治疗、CDK4/6i以及地理区域进行分层。
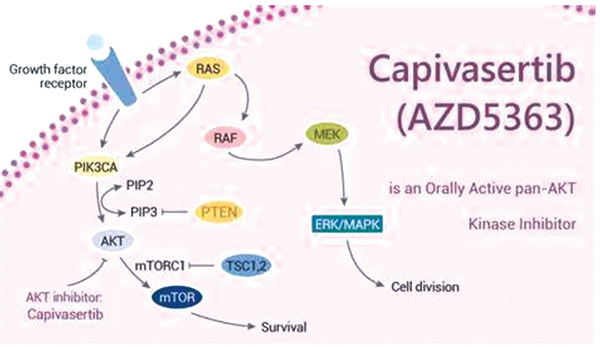
总体人群无进展生存(PFS)获益有统计学意义(HR=0.6,95%CI 0.51~0.71),这一结果来自生物标志物阳性人群中289例患者的数据(HR=0.5,95%CI 0.37~0.68)。研究者评估的生物标志物阴性人群中313例(44%)患者的PFS探索性分析显示获益不确定(HR=0.78,95%CI 0.60~1.01)。使用capivasertib,更多的患者出现≥3级毒性事件。主要事件包括高血糖(18%为所有分级,2.8%≥3级)、皮肤毒性(58%为所有分级,17%≥3级)和腹泻(72%为所有分级,9%≥3级)。 (编译 龚婻)














