肠道分节丝状菌或可助力免疫治疗
美国纽约大学医学院Najar等报告研究显示,肠道中的分节丝状菌(SFB)能激活肿瘤特异性17型辅助性T细胞(TH17),在免疫检查点抑制剂(ICB)治疗下能浸润肿瘤,并转分化为促炎的TH1样细胞。这些细胞能重塑肿瘤微环境,通过高水平促炎细胞因子促进CD8阳性T细胞募集、扩增和效应功能,使ICB对黑色素瘤等肿瘤的杀伤力提升3倍,为全球40%对免疫治疗无效的肿瘤患者带来新希望。(Nature. 2026年1月14日在线版)
尽管特定的细菌分类已被证实与肿瘤患者对ICB治疗的积极临床反应有关,但其中机制仍不明确。目前猜测包括微生物产物,如代谢产物和固有受体配体,可能会重编程髓系细胞,从而降低抗原呈递的激活阈值,促进肿瘤反应性T细胞的激活。另一种可能性是,识别共生菌(微生物相关抗原,MAA)与肿瘤(肿瘤相关抗原,TAA)之间共享抗原的T细胞,在治疗中被激活,从而增强抗肿瘤免疫反应。肠道共生菌能否通过诱导特定的T细胞反应来促进抗肿瘤免疫有待探讨。
基于SFB能稳定定植于无特定病原体(SPF)小鼠肠道内,并能引发强烈且特征明确的CD4阳性T细胞应答,研究者选择SFB作为肠道共生菌的研究对象,改造B16-F10黑色素瘤细胞,使其表达SFB特异性抗原,接种给小鼠,并给予抗PD-1治疗。
有SFB定植的小鼠,在接受抗PD-1治疗后,肿瘤的生长受到显著抑制;无SFB定植的小鼠中,抗PD-1治疗几乎无效。在携带SFB菌群的小鼠中,肿瘤体积缩小率达72%,而无该菌群的小鼠仅28%。在改造的肺癌和结肠癌细胞中,也观察到类似现象。这种差异源于SFB诱导的TH17细胞“变身”能力:它们从肠道出发,穿越全身,在肿瘤微环境中转化为具有强大杀伤力的TH1样细胞。
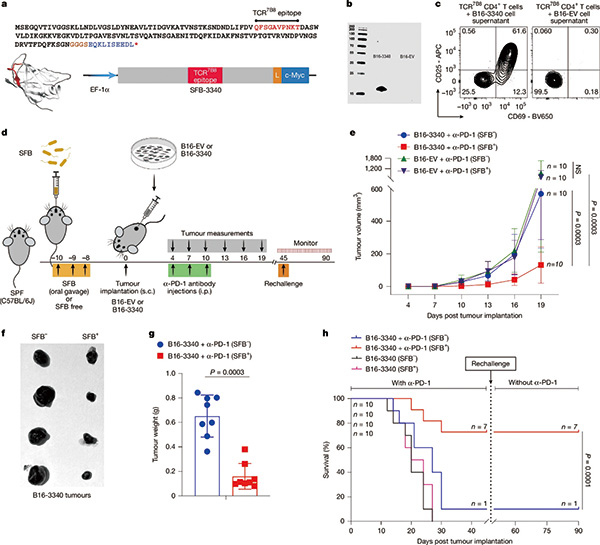
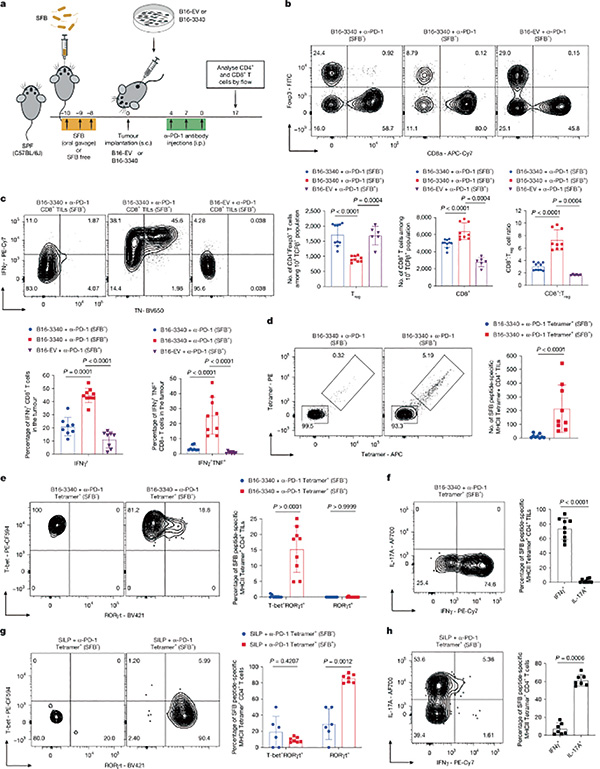
对小鼠免疫细胞组成分析显示,SFB定植显著改变了肿瘤内T细胞组成。SFB小鼠的肿瘤中CD4阳性T细胞比例明显增加,其中包括由肠道诱导的TH17细胞,它们在肿瘤微环境中逐渐转分化为TH1样表型,分泌促炎细胞因子干扰素-γ(IFN-γ)和肿瘤坏死因子(TNF)。肿瘤中的CD8阳性T细胞数量和效应功能增强,表现为颗粒酶B和IFN-γ水平升高。
进一步四聚体检测和T细胞受体(TCR)克隆分析表明,这些肿瘤浸润的CD4阳性T细胞与肠道SFB特异性克隆高度重叠,提示它们最初在肠道被细菌抗原激活,随后迁移至肿瘤并发生表型重编程。对照实验显示,若肿瘤不表达相应的SFB抗原,上述免疫增强效应消失。这表明,肠道细菌与肿瘤之间存在共享抗原的交叉免疫,菌群诱导的T细胞能进入肿瘤并参与抗肿瘤反应。
基因谱分析发现,SFB诱导的“改造T细胞”能同时启动三重攻击:代谢重编程,上调Prf1、Klrc1等基因,使CD8阳性T细胞持续杀伤能力提升5倍;炎症风暴,分泌IFN-γ水平达常规T细胞的8倍,激活巨噬细胞“吃掉”肿瘤细胞;免疫记忆建立,形成Cxcr6阳性记忆T细胞,使治愈小鼠对肿瘤再攻击产生100%抵抗力。
转录组分析显示,SFB定植使肿瘤中的T细胞群整体呈现炎症性和效应性增强的基因表达谱。使用抗体单独耗尽CD4或CD8阳性T细胞时,会失去上述抗肿瘤效果,且CD4阳性T细胞耗尽时,CD8阳性T细胞表现出明显功能受损。提示CD4与CD8阳性T细胞的协同作用是抗PD-1治疗成功的必要条件,前者提供了免疫激活和肿瘤微环境重塑,后者执行对肿瘤细胞的直接杀伤。
研究者通过检测SFB定植小鼠肿瘤浸润T细胞是否表达白介素-17A(IL-17A)确认这些T细胞的来源。这些T细胞确表达IL-17A,这是TH17的标志性细胞因子,提示其确来自于肠道中的TH17,进入肿瘤发生转分化后仍保留表达特征。无SFB定植的小鼠,定植SFB显著增加了肿瘤中表达IL-17A的肿瘤浸润T细胞的比例。
利用基因敲除或抗体阻断IL-17A时,抗PD-1治疗的抗肿瘤效果显著减弱,肿瘤中的CD8阳性T细胞募集和活化明显下降,进一步证实了TH17的核心中介作用。
实验揭示了一个关键治疗窗口:在肿瘤植入后第8~12天补充SFB菌群,抑瘤效果达最佳(肿瘤体积缩小68%)。超过19天后补充,效果骤降至23%。这提示临床可能需要在免疫治疗初期同步调节肠道菌群。
研究者尝试探讨另一种肠道共生菌肝螺杆菌,能否促进抗肿瘤免疫,该菌也在此前研究中被发现可在肠道中诱导免疫反应。但小鼠接种了表达肝螺杆菌抗原的肿瘤细胞后,抗PD-1治疗效果在有和没有肝螺杆菌定植的小鼠中并无差异,也未出现显著促炎性T细胞浸润或CD8阳性效应T细胞活化,提示并非所有肠道共生菌均有促进抗肿瘤免疫作用。
该研究为“微生物辅助免疫治疗”提供了新方案:菌群检测,开发SFB特异性MHCⅡ四聚体试剂,提前筛查患者肠道菌群状态;精准补充,设计含SFB的定向益生菌制剂,与PD-1抑制剂联用;细胞疗法,培养改造T细胞进行过继转移,突破菌群依赖性治疗。
该研究证实,肠道菌群能通过抗原模拟和T细胞可塑性增强ICB治疗的效果,但依赖于特定共生菌,如SFB。未来需在人体试验中验证SFB的安全性和可行性,长期使用SFB是否引发自身免疫需观察。研究者正在开发“菌群芯片”,可快速检测患者肠道内是否含有类似SFB功能的菌群。预计2027年进入临床试验阶段。
(编译 张璇)


