我国首个PD-L1检测试剂盒获批上市
近日,国家药监局发布进口批件通知显示:Dako North America [代理人:安捷伦科技(中国)有限公司]的PD-L1检测试剂盒(免疫组织化学法)正式获批上市,这也是在中国批准上市的首个PD-L1检测试剂盒。

据了解,该试剂盒将用于定性检测中性福尔 马林固定石蜡包埋(FFPE)的非小细胞肺癌(NSCLC)组织中的PD-L蛋白,辅助鉴别可使用Keytruda治疗的NSCLC患者,其产品原理是使用组织染色机(Autostainer Link 48)完成FFPE标本的免疫组织化学(IBC)染色操作所需的优化试剂和染色程序,再使用PD-L单克隆抗体或者阴性对照试剂与标本共同孵育后,依次用宿主一抗的特异性连接抗体和即用型显色试剂(含偶联到葡聚糖聚合物骨架上的二抗分子和辣根过氧化物酶分子)进行孵育。酶催化随后加入的色原,使之在抗原部位生成可见沉积物,通过显色增强剂改良显色反应的颜色。然后,对标本进行复染并封片,使用光学显微镜判读。
大量研究表明,肿瘤组织样本中PD-L1表达水平越高,则意味着患者更可能从PD-1/PD-L1抑制剂治疗中获益。肿瘤组织PD-L1表达水平评估是目前临床研究、验证和认可度最广泛的PD-1/PD-L1抑制剂疗效预测标志物,而免疫组化方法学是现阶段临床诊断级别评估肿瘤组织PD-L1表达水平的唯一方法学。
目前FDA获批具有代表性的4种PD-1/PD-L1单抗(Opdivo、Keytruda、Tecentriq和Imfinzi)都有相对应的伴随诊断联合使用,在临床诊疗实践中,到底是应该先选择PD-L1检测方法还是先选择治疗药物?
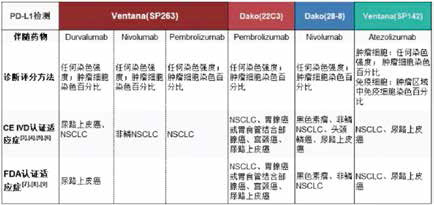
从国际上已报道的研究来看,针对以上4种PD-L1表达检测,2017年发布在《Clinical Cancer Research》杂志上的一项研究显示,SP263和22C3、28-8具有较好的一致性,在PD-L1肿瘤细胞膜染色不同阈值(1%、10%、25%和50%)的比较上,三种方法的总体一致率>90%。
由国际肺癌研究协会(IASLC)发起的Blue Print 1和Blue Print 2研究显示出相似的结果。相比之下, SP142检测肿瘤细胞PD-L1表达需要更高的阈值,但在免疫细胞的检测上具有更好的敏感性,从最新的研究更新来看,SP142在需要或仅需要评估免疫细胞PD-L1表达水平的适应证上具有显著优势。
值得注意的是,VENTANA PD-L1(SP263)可以同时检测细胞膜和细胞质中的PD-L1表达,欧盟体外诊断医疗器械(CE IVD)认证批准可同时指导Opdivo、Keytruda、Tecentriq和Imfinzi治疗是目前国际上关联药物最多的检测。
(编译 王楠)














