新研究再添神经促癌证据
美国MD Anderson癌症中心Amit等研究发现,头颈部肿瘤中,抑癌基因TP53的缺失会导致肿瘤相关的感觉神经元重编程,成为肾上腺素能神经元,从而促进肿瘤的生长和发展。(Nature. 2020; 578:449-454. doi: 10.1038/s41586-020-1996-3.)
神经是构成组织微环境的重要一部分,对于内部器官的生理调节是必不可少的,在肿瘤中也是如此。在肿瘤发展的早期阶段,神经纤维就开始形成并浸润肿瘤组织,由它们发出的信号与肿瘤的发展、侵袭和转移都有着很强的相关性。因此,了解肿瘤与神经之间的相互作用,对了解肿瘤和寻找治疗方法是很有意义的。
研究者指出,这是首次阐明神经元参与肿瘤生长的机制,这也意味着我们有了一个新的肿瘤标志物,以前认为的“神经只是随机扩散到肿瘤中”的观点是完全错误的。

抑癌基因TP53的突变是头颈肿瘤中最常见的一个突变,在肿瘤形成的多个过程中都有参与。同时,它的表达水平在神经再生的过程中波动,从而对不同阶段进行调控。
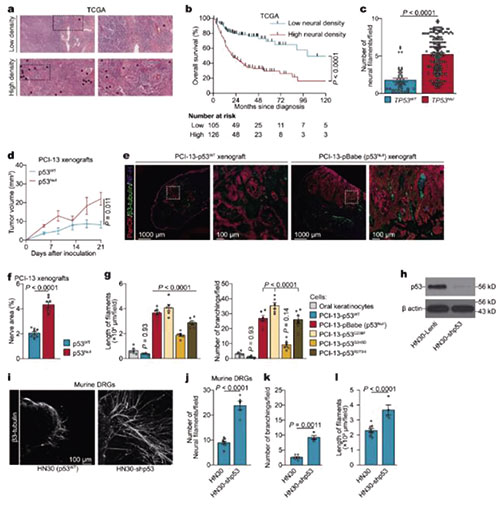
研究者在TCGA数据库中提取了口腔鳞状细胞癌(OCSCC)患者的生存数据,分析发现,患者肿瘤组织中的高神经密度与较差的总生存期和TP53突变有关。
研究者在口腔上皮细胞TP53未突变的对照组小鼠和突变的实验组小鼠中构建了OCSCC模型,发现在TP53突变、缺乏p53蛋白的小鼠中,肿瘤中的神经密度明显更高。在异种移植模型中,结果也是如此。提示缺少p53蛋白可能与肿瘤发生发展过程中的神经形成有关。
p53是如何控制肿瘤中的神经形成的?通过共培养实验,研究者发现,OCSCC细胞会产生细胞外囊泡,细胞外囊泡是一种双层膜结构的囊泡,可携带细胞来源的多种蛋白质、脂类和遗传物质等。
OCSCC细胞产生的细胞外囊泡就携带了miRNA,囊泡里携带哪种miRNA是由p53决定的。研究者对比了p53正常的和缺少p53的OCSCC细胞系产生的细胞外囊泡的miRNA谱,发现有17个miRNA表达和p53有关,其中miR-34a和miR-141的表达在p53正常细胞来源的细胞外囊泡中明显更多。从OCSCC小鼠肿瘤中采集的细胞的结果也是如此。
进一步实验发现,在这两个miRNA中,只有miR-34a对神经的发生有明显的作用,miR-34a缺陷型细胞外囊泡组的神经丝数量是明显更多的。因此,miR-34a对神经发生起到负调节作用,缺少p53的OCSCC细胞会产生细胞外囊泡,囊泡中的miRNA组合缺少miR-34a,向神经传递了“快长”的信号,导致肿瘤中神经的快速生长。
研究者分析了肿瘤中神经元的转录组发现,p53正常的和缺乏的肿瘤中,神经元是不同的。通过IPA方法分析,后者神经元的生长和形态发生、突触形成和传递等方面,都有明显更高水平的基因表达。
患者切除的肿瘤组织中分离的神经纤维的分析结果表明,TP53突变患者酪氨酸羟化酶阳性的肾上腺素能神经纤维密度更高。提示近端肾上腺素能神经元的募集可能与缺少p53的肿瘤发出的信号有关。
通常认为肿瘤中的神经是由周围的神经延伸而来的,但研究者在小鼠中发现,在肿瘤发生之前就切断肾上腺能神经,肿瘤仍能生长,这是肿瘤产生的细胞外囊泡导致的。
在p53正常的癌细胞的细胞外囊泡中,有高水平的miR-34a,而miR-34a的功能就是阻止体细胞重编程,固定体细胞的命运,所以,miR-34a的缺少增加了细胞身份转换的可能性。
随后的实验证实,缺少p53的癌细胞产生的细胞外囊泡将信号传递给了肿瘤附近的一种感觉神经,让其神经元发生了重编程,分化成肾上腺素能神经元。研究者在肿瘤发生之前切断了这种感觉神经,miR-34a找不到与其接头的神经元,肿瘤中的神经密度大大降低,肿瘤也显著缩小。
研究者在小鼠中进行了再次验证,分别给两组小鼠使用卡维地洛(非选择性肾上腺素能受体阻滞剂,治疗原发性高血压和心力衰竭)和安慰剂进行治疗,再接种TP53突变的OCSCC细胞,在心血管血流动力学水平相似的前提下,前者的癌细胞增殖率和肿瘤增长率都明显更低。
另外,对MD Anderson癌症中心70例OCSCC患者的分析也显示,校正了年龄、分期、手术和治疗方法等因素后,肿瘤中的高肾上腺素能神经密度与较短的无复发生存期和总生存期有关。
研究者指出,手术切除肿瘤中发现的神经末梢不容易追溯来源,我们可能忽视了一个非常重要的潜在肿瘤标志物。最近研究表明,神经也主动参与了癌症的发生发展。 (编译 刘佳伟)














