T1~3N0M0期肺部肿瘤 个体化SABR的局部控制良好
美国斯坦福大学医学院Gensheimer等报告,治疗T1~3N0M0期肺部肿瘤时,个体化立体定向消融放射治疗(SABR)可以使治疗剂量最小化,并且与良好的局部控制相关。在未来的试验中,应考虑使用个体化治疗方案。(JAMA Oncol. 2023年9月14日在线版)
在不可手术的早期NSCLC治疗中,SABR早已是临床标准治疗方案之一,且对一些分期极早(如Ⅰ期)的患者,SABR的疗效也可与手术并驾齐驱。但SABR的副作用同样不可忽视,早年一些临床研究中,SABR相关3~4级毒性的发生率可达27%,意味着放疗剂量或需降低,但这又可能增加肿瘤局部复发风险,所以需要在疗效和安全性间权衡。临床研究成果揭示在肺癌治疗中,让立体定向消融放疗(SABR)更安全高效的新方法:将SABR总剂量控制在100 Gy以内,并个体化设计SABR方案,有望更好地平衡疗效和安全性。
为了验证小肿瘤是否不需高剂量SABR,评估根据肿瘤大小、发病部位和组织学特征给予的个体化的肺SABR剂量和分割方案是否与局部肿瘤控制相关,研究者开展了该项多中心非随机化设计的Ⅱ期对照试验(iSABR),研究于2011年11月15日至2018年12月5日在美国和日本的学术医疗中心招募相关患者。
研究者根据癌症类型将患者分为3组:第1组,初始诊断为非小细胞肺癌(NSCLC),AJCC第7版分期为T1~3N0M0期肿瘤;第2组,T1~3N0M0期新的原发性NSCLC,有NSCLC或多发性NSCLC病史;第3组,来自NSCLC或另一实体瘤的肺转移。
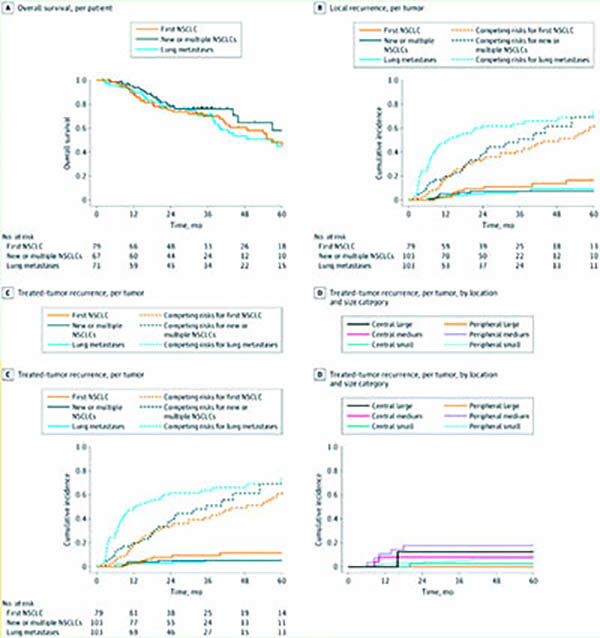
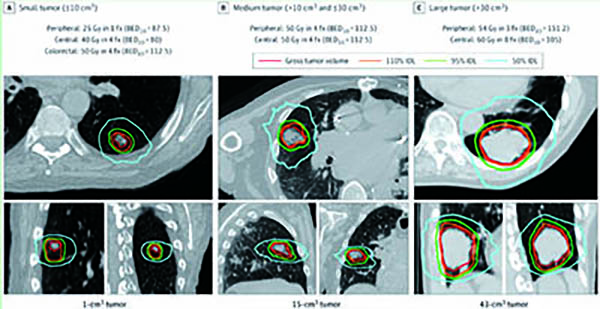
根据患者肿瘤部位和体积,研究者们为每例患者“个性化定制”了SABR方案,至多对4个肿瘤进行放疗,剂量范围则在25 Gy(单次)至60 Gy(8次),体积为0~10 cm3的周围肿瘤病灶为单次分割25 Gy,体积>30 cm3的中央肿瘤病灶为60 Gy/8 f。主要终点为各组1年的无局部复发(同叶复发)率,总生存期(OS)为关键次要终点。
结果显示,共纳入217例患者,中位年龄为72岁(IQR:64~80岁),男性有129例(59%),目前吸烟或曾吸烟者150例(69%)。患者共完成240个疗程,其中第1组79个,第2组82个,第3组79个。总有285个肿瘤病灶接受了治疗,其中外周肿瘤病灶211个(74%),中央肿瘤病灶74个(26%)。
最常见的剂量方案为单次分割25 Gy(158个肿瘤病灶)。中位随访33个月(2~109个月),患者中位总生存期为59个月,中位总生存较短可能与患者相对高龄,因其他原因去世有关。
个体化定制的SABR方案疗效出色,3组的1年无局部复发率分别为97%、94%和96%,达到研究预设的主要终点,2年/5年无局部复发生存率分别在90%~95%和83%~93%,肺癌复发风险有效降低。
个体化定制SABR另一个目标安全性也达到了,放疗相关的3~5级不良事件发生率较低,仅为5%(包括1例肺出血导致的死亡),仅有3例患者出现3级肺炎,常见于接受放疗患者的≥2级胸痛发生率也仅为6%,提示个性化定制SABR安全又高效。
研究解读
美国MD Anderson癌症中心Verma教授指出,该研究为未来的个体化肺部SABR奠定了基础,提示个体化策略不仅获得了较高的局部控制和较低的毒性作用,而且还提供了较高质量的支持。能够优化肺部SABR个体化的其他因素包括确诊至治疗的任何延迟、肿瘤生长动力学、免疫谱、循环肿瘤细胞和放射标志,以及这些因素的结合;而“基因组学调整的放疗剂量”这一概念则是另一个迷人的未来可期的方法。此外,基于列线图和(或)人工智能的工具可能有助于整合上述几个因素,继而确定每个特定病例的最佳剂量/分割方案(和/或最小的生物等效性剂量阈值)。在目前阶段,理想情况下所有患者的SABR剂量都应(至少)根据包括肿瘤大小/体积、发病部位和组织学类型来调整,而应该摒弃“一刀切”(一种生物等效性剂量适用所有人)的做法。
(编译 肖丽)














