国人研究团队开发全新癌症疫苗
北京大学化学与分子工程学院/深圳湾实验室陈鹏团队联合未来技术学院席建忠团队,开发了一种全新思路的瘤内疫苗嵌合体(iVAC),利用细胞内吞机制将抗原肽段送入癌细胞体内,强制癌细胞呈现外源抗原,将癌细胞重新编程为抗原递呈状态,促进了持久的抗肿瘤免疫作用。(Nature. 2026年1月7日在线版)
研究者在前期系统发展膜蛋白靶向降解(meTPD)技术体系的基础上,着眼于将蛋白降解途径与抗原呈递通路在癌细胞内紧密耦合,成功利用meTPD技术,在解除免疫“刹车”的同时,迫使癌细胞呈递在人体中普遍存在的高质量抗原。这种以肿瘤为出发点的“降解疫苗”为克服癌症的免疫耐受提供了新的破解途径。
meTPD的快速发展为这一构想奠定了基础。陈鹏团队在国际上率先开发了一种基于共价纳米抗体(胶水抗体)的“内吞受体非依赖型”膜蛋白降解平台:GlueTAC,可实现免疫检查点蛋白PD-L1的特异性清除。
在此基础上,研究团队注意到,一些膜蛋白在被该技术降解的同时,其下游的抗原加工与呈递通路也会被激活。基于此,他们设计了一种能同时实现“免疫检查点降解”和“高质量抗原递送”的双功能嵌合体,进而改变了肿瘤与免疫系统之间的识别范式,将癌症疫苗的抗原选择从内源蛋白拓展至外源物质。
另一方面,肿瘤微环境中虽然缺乏功能正常的肿瘤特异性T细胞,却存在不少“旁观者T细胞”,比如在流行病感染后产生的记忆型T细胞。这些“旁观者T细胞”虽然无法直接识别肿瘤,但如果癌细胞被迫呈递出与病原体相同的抗原,这些沉睡的免疫战士就能被唤醒,从“旁观”到“参战”,在患者体内建立长效的抗肿瘤免疫响应。
传统的免疫疗法在肿瘤特异性T细胞的产生激活和效应杀伤阶段面临着双重困境:一方面,树突状细胞(DCs)等抗原呈递细胞(APCs)在肿瘤微环境中数量和功能均受限,难以训练出充足的T细胞;另一方面,肿瘤疫苗在淋巴结中诱导产生的T细胞与微环境中实际存在的抗原脱节,易产生耐药性。因此,理想的情况是让肿瘤细胞行使与APC类似的功能,既能利用肿瘤原位的抗原训练出正确的T细胞,又能在高质量抗原的帮助下长效激活T细胞,实现肿瘤清除。
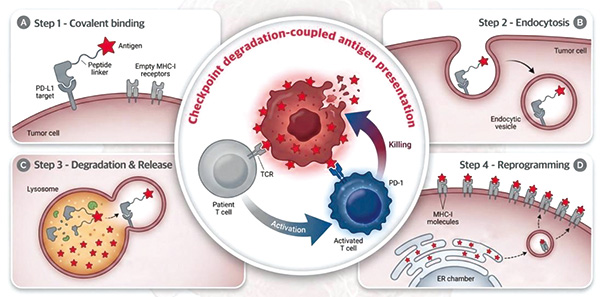
在生理条件下,APC主要依赖模式识别受体(PRR)来摄取抗原,而以GlueTAC为代表的meTPD技术可以突破这一限制,在实现膜蛋白靶向降解的同时充当递送载体,向不表达PRR的肿瘤递送抗原,并迫使肿瘤细胞主动摄取、加工甚至呈递这些抗原。为实现这一目标,团队设计了膜蛋白靶向降解驱动的“瘤内疫苗嵌合体”(Intratumoural vaccination chimera,iVAC)。
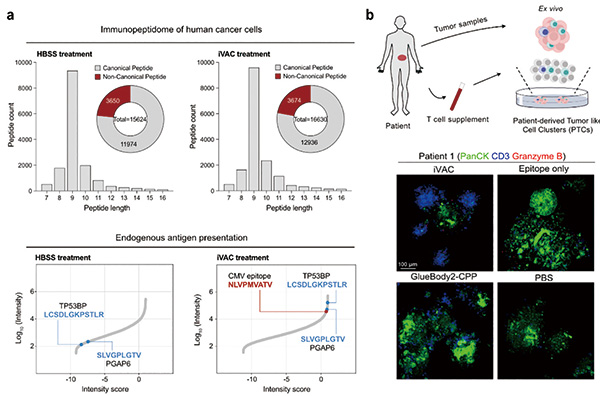
iVAC的技术基础建立在陈鹏团队2021年报告的一项名为GlueTAC的通用膜蛋白靶向降解技术之上。GlueTAC由两部分组成,其一为GlueBody的共价单域抗体,能与靶标膜蛋白形成不可逆共价键,而非传统抗原抗体结合的非共价作用,避免抗体在内吞过程中与靶蛋白解离,提高了降解效率;其二为细胞穿膜肽+溶酶体分选序列,可加速内吞和降解。iVAC携带的抗原可按需选择,研究中选用的巨细胞病毒(CMV)衍生抗原就是一种能诱发强力免疫反应的抗原,在临床前模型中取得了良好的抗肿瘤效果。实验结果显示,GlueTAC能在多种肿瘤细胞模型中快速介导靶蛋白PD-L1内吞和溶酶体降解,持久地激活T细胞、抑制肿瘤生长。
iVAC在GlueTAC的技术上,通过肽连接子加载了一段外源抗原肽,使肿瘤细胞主动吞下毒药,抗原肽段经溶酶体加工,最终以多肽碎片组装复合物(peptide-MHC complex)的形式出现在肿瘤细胞表面,赋予癌细胞新的抗原性。肿瘤细胞被iVAC改造成了一种类APC。
通过化学生物学手段,iVAC分子的三大元件被整合在同一个分子上,分子量仅为18 kDa,拥有良好的实体瘤浸润性。它们分别是:能高效富集于肿瘤病灶的共价型PD-L1纳米抗体、能触发胞吞的降解子、能高效释放抗原的免疫肽段。这一设计成功实现了一场细胞层面的“特洛伊木马”行动,将原本抑制免疫响应的肿瘤细胞,转化为类似DC的免疫系统信使。这一过程被称为“免疫检查点降解耦联的抗原呈递”(Checkpoint degradation-coupled antigen presentation)。
研究结果表明,经iVAC分子“重编程”的肿瘤细胞能够高效激活抗原特异性CD8阳性T细胞,其效果甚至与骨髓来源的树突状细胞(BMDC)相当。这些“被免疫”的肿瘤细胞不仅拥有更丰富的MHC-Ⅰ分子,还能在接触T细胞后显著上调其细胞活化标志物(CD69、CD25、CD44)和细胞毒性分子(GZB、PFN),并促进T细胞分泌细胞因子(IFNγ、TNFα),形成了免疫响应的正反馈循环。
研究者在免疫原性较差的B16细胞系中进行了实验,iVAC处理能显著增加细胞表面MHC-Ⅰ类分子表达,抗原递呈相关基因表达上调、致瘤性降低。在人源化小鼠中接种PD-L1阳性MC38结直肠癌细胞,瘤内注射iVAC可显著抑制肿瘤生长,接受治疗的小鼠全部治愈,长期观察未见复发,且对二次接种表现出明显的抗性,可见iVAC可诱导持久的抗肿瘤免疫。
在实际应用中,iVAC分子所递送的抗原需在广泛的肿瘤症患者群体中具有响应性。基于这一需求,全球感染率超过80%的CMV进入研究者的视野。CMV是一种人类广泛感染的、易自愈的病原体,CMV引起的感染常被人体自愈,多数人在不知不觉中便拥有了针对CMV抗原的记忆型T细胞。这些CMV特异性T细胞在人体内处于“沉睡”状态,数量庞大但无法识别肿瘤,CMV抗原片段在多数癌症患者体内能诱发强力的免疫反应。研究者选择CMV抗原加载到iVAC中,在患者来源的肿瘤类器官模型中验证了其临床转化潜力。负载了CMV抗原的iVAC分子如同一把特殊的“钥匙”,可以在肿瘤原位精准唤醒这支“沉睡军团”。
陈鹏团队将meTPD技术与肿瘤疫苗策略深度融合,实现了“膜蛋白降解耦联的抗原呈递”这一独特机制,在肿瘤原位完成“疫苗接种”,为整个蛋白质靶向降解领域开拓了新的应用场景。
该研究显示,iVAC可使肿瘤细胞转变为类APC状态,增强其抗原递呈能力,有效激活抗原特异性CD8阳性T细胞,并重塑免疫抑制微环境,诱导持久的抗肿瘤免疫作用。或许,iVAC可成为不同患者原位激活抗肿瘤免疫的通用策略。 (编译 张璇)