研究揭示MYC结合新生RNA助免疫逃逸机制
德国维尔茨堡大学Eilers等研究发现,癌蛋白MYC除了传统的转录调控功能外,还能通过结合RNA帮助肿瘤免疫逃逸的重要功能。MYC能通过与RNA结合,招募核外切酶复合体促进RNA降解,防止具有免疫原性的RNA-DNA杂交分子(R环)形成,避免激活模式识别受体TLR3信号通路调控的先天免疫反应。(Cell. 2026年1月22日在线版)
作为一种转录因子,MYC蛋白通过与DNA结合调控多种蛋白的表达,很多肿瘤高表达MYC促进细胞生长、增殖并重编程细胞代谢。不过,MYC还可帮助一些肿瘤构建免疫抑制的微环境,使肿瘤实现免疫逃逸。MYC的传统促癌机制难以解释肿瘤的免疫逃逸现象。
研究者发现:敲除MYC编码基因会导致先天免疫激酶TBK1活化,进而引发干扰素反应并清除肿瘤;其次,TBK1的活化依赖于模式识别受体TLR3对双链RNA或源自核内RNA-DNA杂合体(R环)的识别,提示MYC可能直接参与了这些核酸分子的代谢过程。
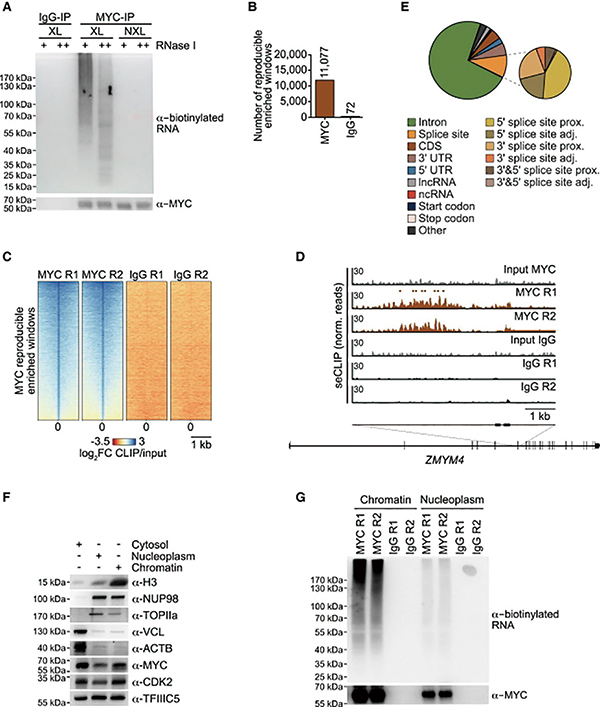
研究者借助凭借eCLIP-seq、ChIP-seq、DRIPc-seq、RNA测序等技术研究证实,在转录延伸受到干扰或发生应激(如剪接体受阻)的情况下,MYC蛋白会在转录过程中发生位置转移,从它在DNA上的常规结合位置移动到新生RNA上。值得注意的是,70%的结合发生在内含子RNA中。
在MYC结合RNA后,会通过RBRIⅡ区域发生相变,形成多聚体结构;这些MYC多聚体会充当降解因子的集合枢纽,负责将核外切酶体及其靶向复合体聚集在R环周围,降解那些异常积累的RNA。
若无癌蛋白MYC帮助癌细胞清除基因转录过程中形成的R环(RNA-DNA杂合体),那些具有较强免疫原性的R环就会进入细胞质,结合并激活模式识别受体TLR3;TLR3的激活会进一步触发先天免疫激酶TBK1的磷酸化和活化,进而启动干扰素反应,并招募免疫细胞来清除肿瘤细胞。
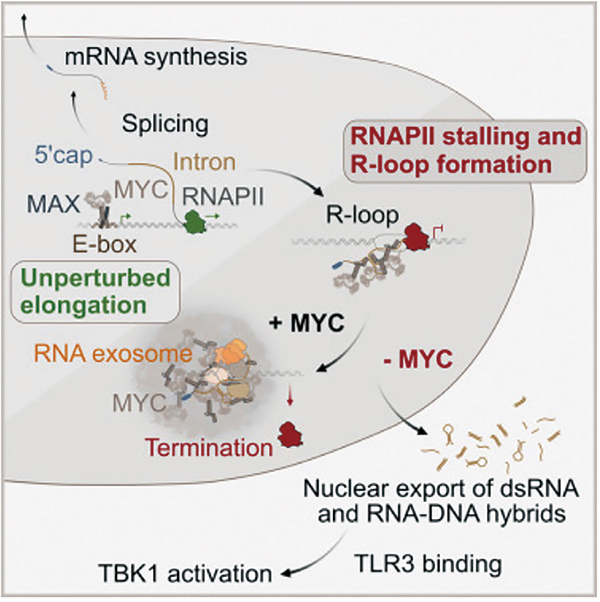
MYC中的RBRIⅡ区域对于它与RNA结合至关重要,如果没有RBRIⅡ,R环就会在癌细胞内大量堆积,激活先天免疫系统,抑制肿瘤的生长。有趣的是,在正常情况下,RBRIⅡ结合RNA的功能独立于MYC的典型转录激活功能。也就是说,RBRIⅡ突变并不影响MYC对启动子处DNA的结合,也不影响其对经典靶基因的调节能力。
该研究表明,MYC在转录和RNA代谢中具有机制不同的功能。在肿瘤细胞中,它不仅可促进细胞增殖,还能帮助癌细胞实现免疫逃逸,且这两个功能在机制上互相独立。因MYC对正常细胞生存也非常关键,开发靶向MYC的抗癌药物充满挑战。该研究有望给MYC驱动的肿瘤带来新治疗靶点,即阻止MYC的RBRIⅡ与RNA的结合,激活先天性免疫反应。 (编译 王悦翔)


