研究发现细胞周期阻滞剂增强T细胞抗肿瘤能力
荷兰莱顿大学医学中心van Haften等研究发现,即使被阻滞在细胞周期中的活化CD8阳性T细胞,仍能完成效应分化。处于细胞周期阻滞的CD8阳性T细胞会发生代谢重编程,进入一种高能量状态,从而在解除阻滞后实现快速且增强的增殖。这种代谢变化由营养物质的摄取、储存和加工增加驱动,导致阻滞期细胞的糖酵解增强。在分子机制层面上,是由阻滞期间升高的白细胞介素-2(IL-2)激活STAT5信号支持的。短暂的细胞周期阻滞能够在免疫检查点抑制、过继性T细胞转移和治疗性疫苗等模型中实现更好的由CD8阳性T细胞介导的肿瘤控制,提升免疫治疗疗效。(Nat Immunol. 2026年1月19日在线版)
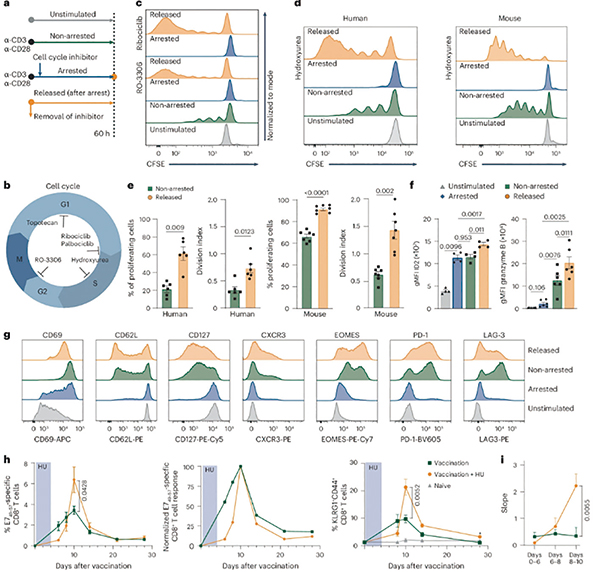
研究者使用多种不同细胞周期阻滞剂,在不同阶段阻断CD8阳性T细胞的细胞周期,发现经过阻滞再释放的这些细胞竟然有更强的增殖能力,且不局限于特定药物或细胞周期。生物标志物层面看,与效应功能有关的标志物ID2、EOMES、CXCR3、颗粒酶B在释放后显著上调,PD-1和LAG-3也有所上调,但未表现出明显的耗竭特征。在小鼠实验也验证了这种CD8阳性T细胞的变化。
转录组分析显示,阻滞、释放、未阻滞和未受刺激的4种CD8阳性T细胞的转录组特征有所不同,阻滞和释放状态显著改变了糖酵解、胆固醇合成、IL-2-STAT5信号、PI3K-AKT-mTOR 信号等通路,在阻滞期已上调的糖酵解和胆固醇合成相关基因表达在释放后进一步增强。阻滞期时的转录组接近静息记忆T细胞,而释放后的转录组则接近再激活的记忆T细胞。
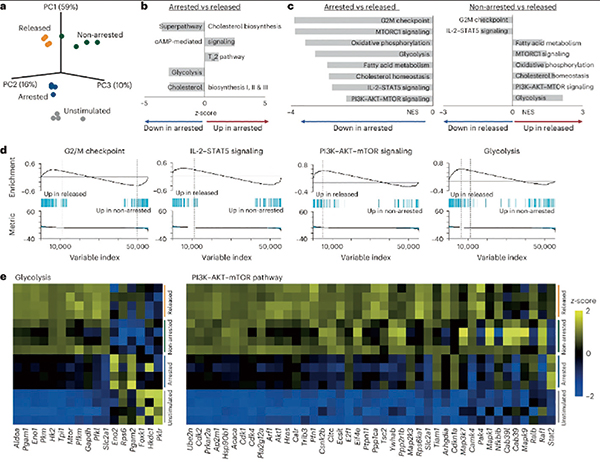
细胞内代谢物分析发现,阻滞期的CD8阳性T细胞积累了大量葡萄糖和氨基酸,表明细胞在非增殖状态下仍持续摄取并储存营养物质。氨基酸转运蛋白CD98和葡萄糖转运蛋白GLUT1在阻滞期上调,而糖酵解关键酶PKM、ALDOA以及戊糖磷酸途径限速酶G6PD的表达在释放后进一步增强,使得释放后的细胞具备更高的葡萄糖代谢能力。
功能上,阻滞期细胞大量储存糖原,而释放后迅速消耗这些储备以支持快速增殖,抑制糖原分解或葡萄糖摄取均会显著削弱释放后的增殖能力。阻滞期CD8阳性T细胞的线粒体活性和三羧酸循环增强,同时脂肪酸氧化相关酶CPT1a及胆固醇合成关键酶FDFT1上调,进一步支持其进入一种高能量预备状态。
分子机制探索发现,在阻滞和释放中发生改变的信号通路中, mTORC1并非主要驱动因素,IL-2-STAT5信号在阻滞期显著增强,是支持后续改变的关键,阻断IL-2或STAT5信号会显著降低释放后的细胞增殖能力。
研究者在多种免疫治疗模型中测试了暂时阻滞细胞周期的效果,包括免疫检查点抑制剂(PD-1/PD-L1抑制剂)、过继性T细胞转移和治疗性疫苗。在这3种小鼠模型中,短暂的细胞周期阻滞均增强了CD8阳性T细胞的扩增和效应功能,释放后,对肿瘤的抑制效力更强,小鼠生存期延长,且T细胞未出现耗竭表现。
在CD8阳性T细胞中,暂时的细胞周期阻滞并不会抑制效应分化,反而通过代谢重编程和IL-2/STAT5信号激活,使其进入一种高能量预备状态。在阻滞期,CD8阳性T细胞主动积累葡萄糖、氨基酸并储存糖原,同时增强胆固醇合成和脂肪酸氧化能力,从而在释放后能快速消耗储备,进入高水平的糖酵解和增殖。
这种代谢印迹使它们在释放后表现出类似记忆T细胞再激活的特征,具备更强的效应功能和抗肿瘤能力,从而提供了一种新的免疫调控策略,通过暂时解耦CD8阳性T细胞的增殖与分化,诱导其代谢重编程,从而增效抗肿瘤免疫。
(编译 秦盛泽)


