当前位置:首页
-
28 2026.02 我院召开2025年度领导干部述职暨民主测评会
-
14 2026.02 共绘荣光•同启华章丨北京大学肿瘤医院建院50周年LOGO正式发布
-
06 2026.02 2025年中华医学科技奖揭晓 我院2项成果获奖
-
02 2026.02 我院召开2025年度党支部书记现场述职会
- 寒冬中的生命接力——我院两位医生火车站救助急症旅客 2026-01-23
- 心音十载 乐润新生——北京大学肿瘤医院心音坊十年重启音乐会召开 2025-12-31
- 热烈祝贺 | 北京大学肿瘤医院季加孚教授当选中国工程院院士 2025-11-21
- 外科系统
- 内科系统
- 医技科室
- 基础实验室
- 行政科室
外科系统
内科系统
基础实验室
- 让患者在音乐中获得疗愈!北大肿瘤医院重启人文品牌“心音坊”
- 真相来了丨喝豆浆吃豆制品会诱发乳腺癌?专家详解常见误区
- 推动国际首个PD-L1单抗获批胃癌适应证,这项研究见刊JAMA!
-

北肿微课堂-科普小程序
600条原创科普视频
扫码随时观看

中国方案引领胃癌综合治疗新征程 浏览量:0
北京大学肿瘤医院
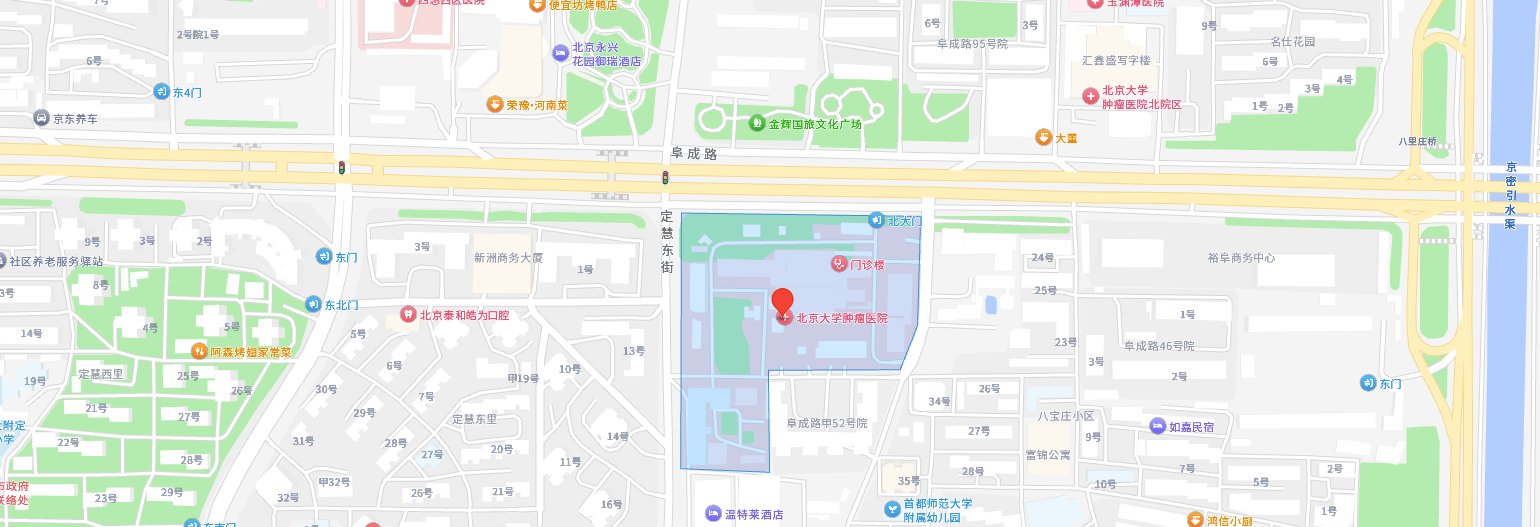
主院区
地址:北京海淀区阜成路52号(定慧寺)
路线:地铁10号线西钓鱼台站C口出,向北步行50米至阜成路,转向西步行800米,抵达门诊。
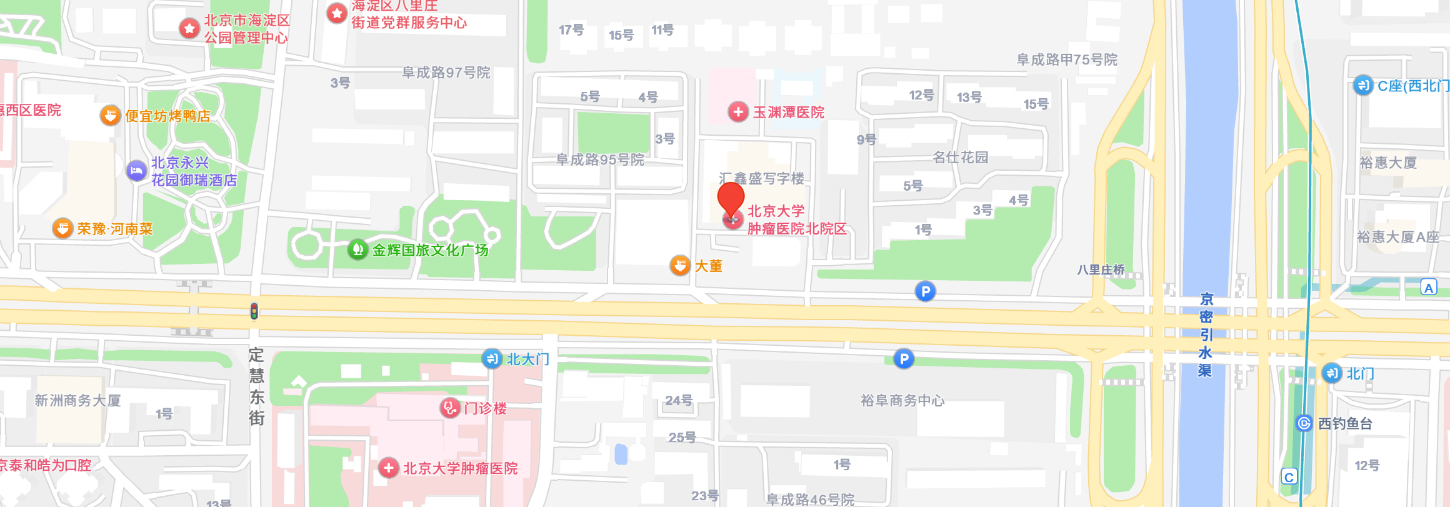
北京大学肿瘤医院
北院区
地址:北京海淀区阜成路81号院1号楼
路线:地铁10号线西钓鱼台站A口出,沿阜成路辅路向西步行约710米,达到北院区























