- 院所概况
- 就诊服务
-
科室介绍
科室介绍
特色医疗
特色科室
- 胃肠肿瘤中心一病区
- 胃肠肿瘤中心二病区
- 胃肠肿瘤中心三病区
- 胃肠肿瘤中心四病区
- 肝胆胰外一科
- 胸外一科
- 肝胆胰外二科
- 胸外二科
- 乳腺癌预防治疗中心
- 妇科肿瘤科
- 头颈外科
- 骨与软组织肿瘤科
- 泌尿外科
- 家族遗传性肿瘤中心
- 乳腺肿瘤内科
- 胸部肿瘤内一科
- 胸部肿瘤内二科
- 淋巴肿瘤内科
- 消化肿瘤内科
- 黑色素瘤与肉瘤内科
- 泌尿肿瘤内科
- 日间化疗病区
- 中西医结合科暨老年肿瘤科
- 康复科
- 介入治疗科
- 口腔科
- 肿瘤放疗科
- 手术室
- 重症医学科
- 麻醉科
- I期临床病区
- VIP-II
- VIP-Ⅰ
- 移植与免疫治疗病区
- 疼痛门诊
- 肿瘤外科
- 肿瘤内科
- 心内科1
- 肿瘤中医
- 疼痛与睡眠
- 康复中医
- 综合研究型病房
- 职工保健
- 支持治疗科
- 生化与分子生物学研究室
- 病因学研究室
- 遗传学研究室
- 流行病学研究室
- 分子肿瘤学研究室
- 中心实验室
- 临床实验室
- 图书馆
- 实验动物室
- 生物样本库
- 细胞生物学研究室
- 家族遗传性肿瘤中心实验室
- 肿瘤生物信息中心
- 胃肠肿瘤生物学研究室
临床科室医技科室基础科室行政处室 -
专家介绍
专家介绍
-
科普园地
科普园地
疾病专题
健康大讲堂
-
仁医陈敏华 用射频针创造生命艺术 浏览量:3718
-
【北京您早】恶性肿瘤成北京市民头号杀手 浏览量:1683
-
【生活大调查】终结癌症传言 浏览量:2730
科普园地
防治雾霾
健康自测
-
食管癌切除术后生存预测
| 北京市重点肿瘤高危人群自我评…
| 疲劳度自测
| 便秘自测
| 自己检查胃肠病
癌症康复杂志
《癌症康复》分为三大部分。第一部分癌症康复总论,主要介绍了癌症病人的心理调整、饮食营养、心身锻炼、生活指导等基本的康复知识、技能和方法。
综合资讯
-
- 招聘动态
-
院务公开
院务公开
-
院刊杂志
院刊杂志
Chinese Journal of Cancer Research
The Chinese Journal of Cancer Research publishes high-quality original articles reporting new information on basic and clinical aspects of cancer research and related subjects.
全球肿瘤快讯
院报专栏
癌症康复杂志
《癌症康复》分为三大部分。第一部分癌症康复总论,主要介绍了癌症病人的心理调整、饮食营养、心身锻炼、生活指导等基本的康复知识、技能和方法。
北京大学肿瘤医院
返回
顶部
网站导航
研究揭示肿瘤治疗对正常细胞突变的影响
作者: 来源: 发布时间:2026-01-08
英国弗朗西斯·克里克研究所Pich等,使用高深度双链测序技术检测了肿瘤患者正常组织样本,在肝脏样本中识别出了酒精相关突变,在肺和心脏组织中识别出吸烟相关突变,以及多种治疗相关突变,与治疗类型和持续时间相关。在接受系统性抗肿瘤治疗的正常组织中,约有超过25%的驱动突变可归因于治疗。免疫治疗虽然未与突变负荷增加相关,但与PPM1D和TP53驱动突变相关,表明即使非致突变治疗也能通过选择压力塑造体细胞演化。(Nature. 2025年12月10日在线版)
该研究选择英国多中心泛癌种尸检项目PEACE队列样本,使用高深度双链测序技术(每个样本的中位深度为30 504×),分析了22例转移性肿瘤患者168个非癌变的新鲜冷冻组织标本(156个正常组织样本和22个血液样本)和5个肿瘤样本,涵盖16种器官,30个已知的癌基因,包括TP53、EGFR、KRAS和BRAF等。结果在每个样本中均检测到体细胞突变,共识别出166 732个单碱基替换(SBS)、16 108个插入-缺失突变(indel)和2399个双碱基替换(DBS),多数变异等位基因频率较低(VAF 中位值为0.0000323)。
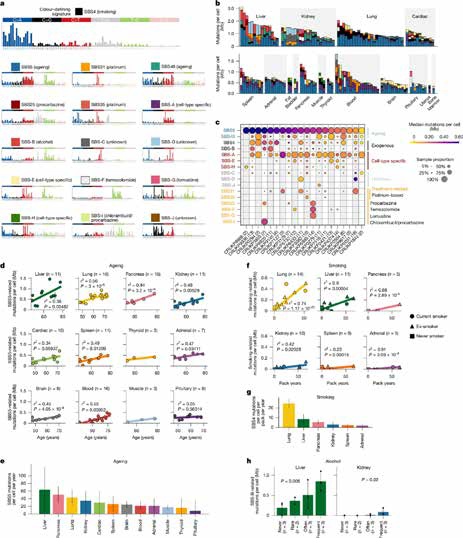
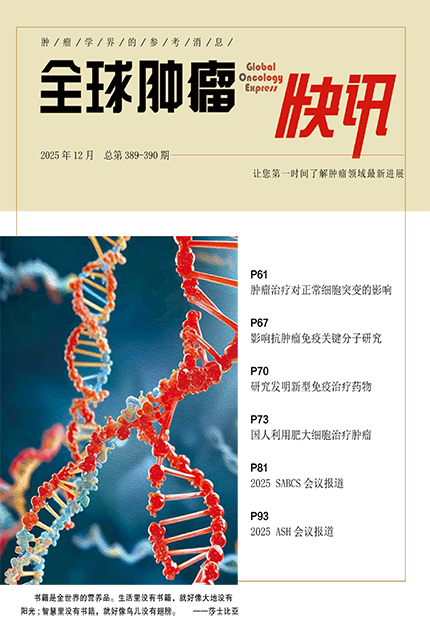
在正常组织中寻找基因突变,因正常组织体细胞突变往往以极低频率散落在不同细胞中,常规基因组测序技术错误率高于稀有突变发生率,导致无法区分真实生物学突变和机器测序噪音。研究者采用的双链测序技术不仅读取DNA序列,还能给每个DNA分子的正反两条链都加上独特的分子标签,只有正义链和反义链测序结果完全一致时,突变方被认定真实存在。研究者采用的双链测序技术(每个样本的中位深度为30 504×),意味着基因组上每一个位点均被反复读取3万次以上,这种深度使得可以捕捉到突变等位基因频率(VAF)低至中位数0.0000323的微痕。
即使没有肿瘤治疗,人体细胞也不断在积累突变。研究显示,所有样本中,一种名为 SBS5的突变占主导,每个样本中约40%为该基因突变,学界称之为时钟样特征,随年龄增长在基因组中稳步累积。研究发现,不同器官该突变存在差异,肺部细胞每年约获得43个由 SBS5引起的突变,血液和脑组织分别24和21个,提示不同组织微环境下细胞周转率和DNA修复能力存在差异。
研究发现了吸烟直接相关的突变特征 SBS4。吸烟每增加一个“包-年”(每天吸一包烟持续一年),每个肺细胞的基因组中就会增加约 20个突变;心脏和肝脏组织中,每增加一个包-年,这些器官的细胞大约会积累5个突变。即使是已戒烟的“前吸烟者”,突变积累速度可能减缓,但DNA上的突变储备依然存在,数量与吸烟总量呈显著正相关,40包-年的吸烟量导致的突变数量约等于20年衰老。
在肝脏中,研究者鉴定出一种与酒精摄入高度相关的突变特征 SBS-B。这种特征在16个肝脏样本中的15个被检测到,且在某些样本中,它贡献了高达38%的突变负荷。分析表明,SBS-B的突变负荷与患者自我报告的酒精单位摄入量显著相关。
研究量化了含铂类化疗药物(如顺铂、卡铂)对正常组织的诱变效应。铂类药物通过与DNA结合形成加合物,导致DNA交联,从而杀死肿瘤细胞,但同时也对正常细胞造成巨大损伤。研究识别出与铂类治疗相关的突变特征 SBS31 和 SBS35,发现治疗周期越长,突变负荷越高。这种影响在不同组织是不同的,血液系统是化疗诱变重灾区,每一个周期的铂类化疗,会导致每个血液细胞增加约 89个突变。换算成衰老时间,血液中,仅6周期铂类化疗(许多肿瘤的标准疗程)造成的突变积累量相当于人体自然衰老27年。肺部对铂类化疗敏感度略低,6周期化疗在肺细胞中产生的突变量约相当于5年的自然衰老。脑和肾上腺组织中,每周期化疗引起少于27个突变。
在一例患者血液样本中,研究者估算,在患者51年的人生中积累了1082个与年龄增长相关的突变,在短短治疗期间,铂类化疗就引入1420个突变,这种突变暴发在极短时间内重塑正常组织基因组景观。
研究者在接受替莫唑胺治疗的胶质母细胞瘤和黑色素瘤患者正常组织中,发现一种特征性突变模式SBS-F,这种特征与DNA错配修复机制下的损伤修复有关。在脾脏、垂体和心脏组织中,替莫唑胺相关的突变负荷最高,其中位数贡献了高达20%的突变,部分样本甚至达到43%,提示这种口服化疗药物能够穿透血脑屏障,同时也对全身多个器官系统产生深远的诱变影响。
研究者观察到一种特定的插入/缺失(Indel)突变特征——ID-E。在接受过放疗患者的脑、垂体和肺组织中,这一特征显著富集。虽然每个细胞每兆碱基平均只有0.04个这样的突变,但它们忠实地记录了高能射线穿过组织的路径。
在一个接受了低甲基化药物(guadecitabine)治疗的患者血液样本中,研究者发现了一种全新的此前在COSMIC数据库中未被描述的突变特征 SBS-J,主要表现为C>G的颠换,提示许多新型抗肿瘤疗法的潜在基因组毒性,可能隐藏在我们的认知盲区中。
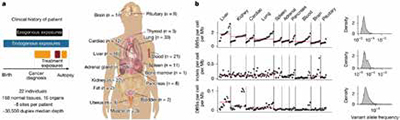
研究者发现,免疫检查点抑制剂这类非诱变性治疗同样能强力重塑体细胞演化。虽然免疫治疗并未增加总体的突变负荷(未引入新的诱变特征),但却显著改变了驱动基因的选择压力。分析显示,接受免疫治疗的患者,其正常组织中 PPM1D 和 TP53 的驱动突变频率显著增加。特别是 PPM1D,这个基因在克隆性造血中扮演重要角色,该基因突变能抑制p53通路,从而帮助细胞在炎症或免疫攻击的压力下存活。
研究者还观察到免疫治疗背景下 B2M 基因突变的富集。B2M 是MHC-Ⅰ类分子的关键组分,其失活会导致细胞表面不再呈递抗原,从而让细胞“隐身”,躲过T细胞的杀伤。提示免疫治疗创造了一个特殊的微环境,通过“环境筛选”而非“制造突变”的方式,同样是体细胞演化的强大推手。
在不同治疗方式下,正常组织中的驱动突变有相当比例可以明确归因于治疗本身。以TP53为例,血液样本中约20%的TP53驱动突变可归因于铂类化疗,肺组织约为26%,肝脏约为18%~20%。在接受替莫唑胺的患者中,血液样本中约45%的TP53驱动突变与药物相关,脾脏中约35%,肺部组织约20%。此外,肝脏中NFE2L2驱动突变约18%可归因于铂类治疗,而PPM1D 驱动突变则与铂类和免疫治疗均相关。
该研究揭示了生活方式和抗肿瘤治疗策略对正常组织体细胞演化的深远影响。未来还需要更多的研究来量化和评估这些外源因素诱导突变对不同正常细胞类型的影响,以及与体细胞演化、早衰和疾病发展之间的关系。该研究提示我们,肿瘤治疗的长期风险和生活方式的叠加效应需要重新审视,要在治愈当前肿瘤与保护长期基因组完整性之间平衡。
(编译 张娜)