研究者发现全新的免疫疗法 肿瘤细胞表面加载病毒抗原 利用抵抗病毒的T细胞杀灭肿瘤细胞
美国哈佛大学医学院Millar等报告了一种新的免疫治疗方法,研究者使用自己开发的一种工程蛋白,在肿瘤细胞表面加载了巨细胞病毒(CMV)的抗原肽,利用人体内普遍存在的CMV特异性T细胞杀死肿瘤。在小鼠模型中,这一新型免疫疗法有效减缓了肿瘤的生长,延长了小鼠寿命。(Nat Biotech. 2020年2月10日在线版)

当前的肿瘤免疫治疗,有给免疫细胞松绑的免疫检查点抑制剂,有帮助免疫细胞认出肿瘤的癌症疫苗,还有改造免疫细胞的CAR-T、CAR-NK。
肿瘤免疫治疗离不开肿瘤新抗原的表达。比如PD-1抗体等免疫检查点抑制剂,其疗效和肿瘤突变负荷(TMB)高度相关,肿瘤突变越多,产生的新抗原也就越多。而癌症疫苗,也要根据肿瘤中产生的新抗原去设计,好让免疫细胞能更好地识别癌细胞。
而那些TMB较低的肿瘤,可供T细胞识别的新抗原十分有限,许多肿瘤都缺乏足够的新抗原来让免疫治疗大显身手。要解决这个问题,一个办法就是往肿瘤上给加新抗原。
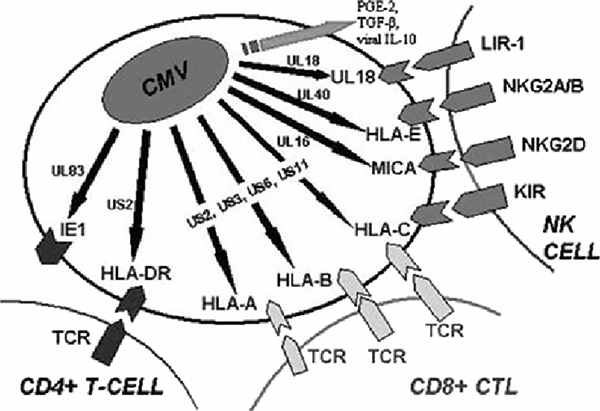
巨细胞病毒是一种人类普遍感染的病毒,多数情况下对健康没有影响。巨细胞病毒在初次感染后经常会潜伏在人体内,进化出许多与肿瘤类似的免疫逃避机制,比如抑制HLA-I类抗原的处理、抑制细胞毒性T细胞(CTL)和NK细胞的功能等。
巨细胞病毒在人体内的长期存在也使得许多人都有巨细胞病毒特异性的CTL(CMV-CTL)。在肿瘤里也发现了不少CMV-CTL,只是受限于抗原识别的特异性,无法杀伤肿瘤。这些针对巨细胞病毒的CTL是否可以利用起来?
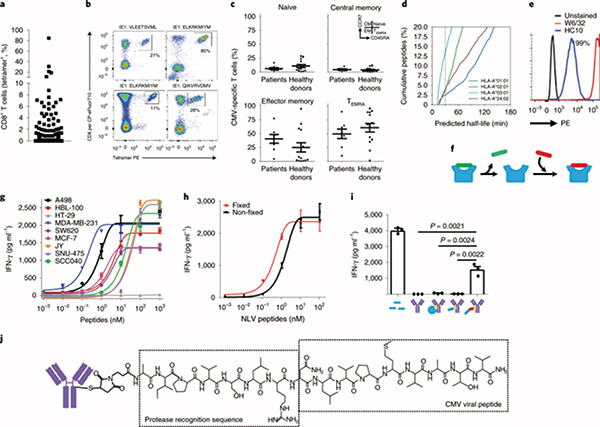
要利用这些CMV-CTL,就得让肿瘤细胞表面上有巨细胞病毒的抗原。研究者发现,在肿瘤细胞表面呈递自身抗原的HLA-I类分子,与其所呈递的抗原的结合并不牢固,有不少被呈递的抗原已经脱落,剩下空白HLA分子。如此,只要把巨细胞病毒的抗原肽加进去,就能跟肿瘤细胞结合了。
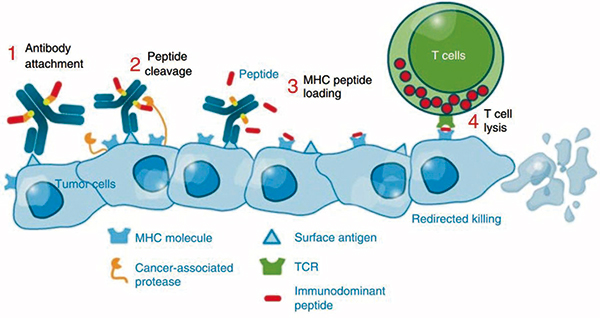
当然,这样的空白HLA位点,正常细胞上也有。要把CMV的抗原肽特异性地加载到肿瘤细胞表面,就需要抗体的帮忙。研究者将其称之为抗体引导的肽-表位偶联(APEC)。
APEC的原理与抗体偶联药物十分相似,它一端是用来识别肿瘤的抗体,比如利妥昔单抗和西妥昔单抗,另一端是巨细胞病毒的抗原肽,两者之间的连接肽包含一个肿瘤特异性的蛋白酶识别位点。APEC结合到肿瘤上后,连接肽被切断,让搭载的抗原肽结合到肿瘤细胞表面空白的HLA分子上。
体外实验中,基于利妥昔单抗构建的APEC,成功地对表达CD20的恶性B细胞进行了表面抗原重编程,而未影响正常的B细胞。
通常像APEC这种增强T细胞对肿瘤识别的方法,只在血液系统肿瘤中有效。而实体瘤中存在调节T细胞(Treg),会抑制抗肿瘤免疫,导致疗效不佳。不过研究者认为,APEC特异性地激活CMV-CTL,而不激活免疫抑制的Treg,可以避免这一问题,研究者于是在小鼠中进行了治疗实体瘤的试验。
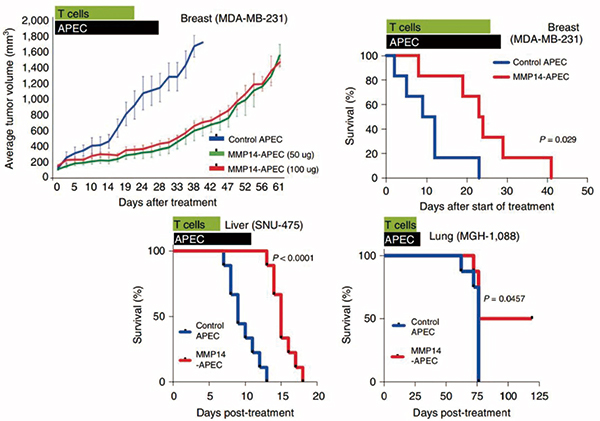
研究者选用免疫缺陷小鼠,向其中移植了人类MVC-CTL,然后分别接种上EGFR阳性肺癌、乳腺癌和肝癌细胞,给予基于西妥昔单抗的APEC(cAPEC)治疗。
在乳腺癌小鼠中,搭载CMV抗原肽的cAPEC进入了肿瘤中心,成功激活了肿瘤里浸润的CMV-CTL的细胞毒性,抑制了肿瘤生长。疗效上,相比于搭载不相干肽的对照cAPEC,搭载CMV抗原肽的cAPEC在三种肿瘤中均显著延长了小鼠寿命。
研究者指出,除了用巨细胞病毒构建APEC,像EB病毒等其他在人类中造成广泛持续感染的疱疹病毒,也可用其抗原肽来构建APEC,治疗低TMB的肿瘤。
(编译 余新)














