研究揭示CLDN18.2靶向治疗耐药机制
复旦大学附属肿瘤医院刘静教授、天津医科大学肿瘤医院郝继辉教授等报告,KRAS突变和高血糖驱动CLDN18.2在其C端T204位点可发生O-GlcNAc糖基化修饰。这一关键修饰的发生导致CLDN18.2在细胞质内异常累积,而非正常定位于细胞膜。这种胞质滞留的O-GlcNAc-CLDN18.2不仅失去作为理想靶点的特性,更转变为驱动肿瘤恶性进展的因子。O-GlcNAc修饰的CLDN18.2促进不良预后并降低CLDN18.2靶向治疗的有效性。低剂量MRTX1133通过减少CLDN18.2的O-GlcNAc糖基化恢复其膜定位,并增强CLDN18.2靶向治疗的疗效,为KRAS突变的胰腺导管腺癌(PDAC)提供了一种新的联合治疗策略。(Gut. 2026年1月9日在线版)
CLDN18.2已成为胃癌和胃食管结合部癌中一个有前景的治疗靶点。然而,其在PDAC中的临床疗效有限,提示存在损害其疗效的调控机制。
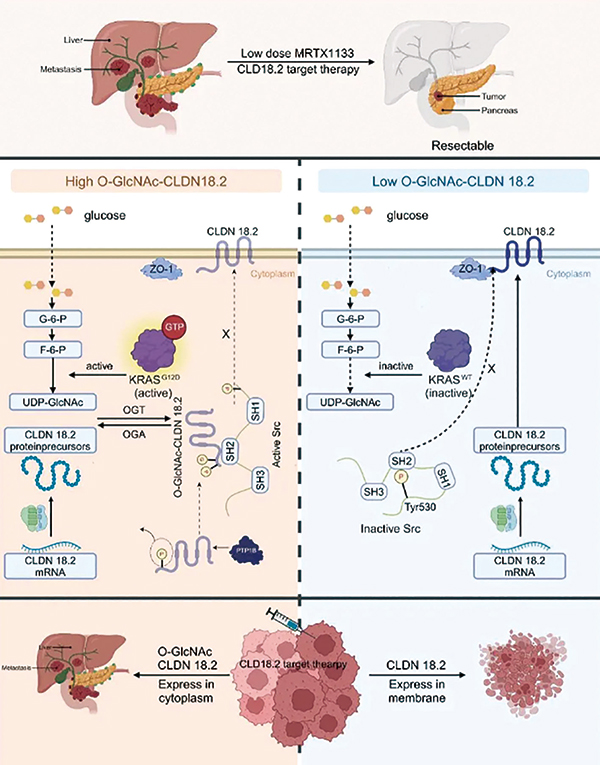
该研究旨在探讨O-GlcNAc糖基化如何影响CLDN18.2的亚细胞定位、肿瘤进展和治疗耐药,并探索恢复治疗敏感性的策略。研究使用了PDAC患者样本及以下模型:人源化患者来源异种移植模型、患者来源类器官(PDO)模型、原位PDO异种移植模型、KPC(LSL-KrasG12D/+;LSL-Trp53R172H/+;Pdx1-Cre)小鼠模型以及KPC-Cldn18.2基因敲除小鼠模型。
KRAS突变和高血糖协同驱动CLDN18.2在T204位点发生O-GlcNAc糖基化,促进CLDN18.2在细胞质中积累。O-GlcNAc修饰的CLDN18.2促进胰腺癌的迁移、侵袭和转移,并降低其对基于抗CLDN18.2的靶向治疗的敏感性。
机制上,O-GlcNAc修饰的CLDN18.2与PTP1B的结合减少,导致其酪氨酸磷酸化增强。O-GlcNAc修饰的CLDN18.2通过SH2结构域招募Src,触发Src活化。遗传学(T204A突变)或药理学阻断O-GlcNAc糖基化可恢复CLDN18.2的膜定位并抑制肿瘤进展。治疗上,低剂量MRTX1133可降低O-GlcNAc糖基化水平,并在KRAS突变的PDAC模型中与CLDN18.2靶向治疗产生协同作用,且副作用最小。
该研究不仅阐明了胰腺癌中CLDN18.2功能紊乱和靶向治疗疗效抵抗的内在分子基础,并将机制发现转化为潜在可行性的临床治疗方案。建议对KRAS突变的PDAC患者,在治疗前通过病理检测评估CLDN18.2的定位与修饰状态,并对符合条件的患者采用“低剂量KRAS抑制剂 + CLDN18.2靶向治疗”的联合策略。这一方案有望克服单一靶向治疗的局限性,为目前治疗选择匮乏的胰腺癌患者提供新的精准治疗希望。 (编译 吴莉莉)














