盘点美国 FDA 近期几项新药加速审批
近期,美国食品药品监督管理局(FDA)发布了治疗弥漫性大B细胞淋巴瘤(DLBCL)、小细胞肺癌(SCLC)、急性髓系白血病(AML)、胆管癌和移植物抗宿主病的药物的监管决定。(自FDA)
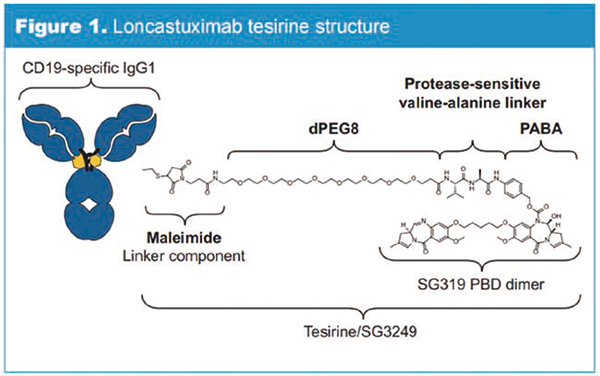
Loncastuximab tesirine治疗复发/难治性DLBCL
FDA基于LOTIS 2数据许可Loncastuximab tesirine治疗复发/难治性DLBCL,并予以“优先审查”资格,且将PDUFA的目标日期定为2021年5月21日。
Loncastuximab tesirine(曾称ADCT-402)是一种抗体-药物偶联物,包括靶向CD19的人源化单克隆抗体、偶联接头和吡咯并苯并二氮杂(PBD)二聚体细胞毒素。一旦与表达CD19的细胞结合,Loncastuximab tesirine可被细胞内化,随后释放弹头。弹头不可逆地与DNA结合,形成能阻止DNA链分离的、强效的链间交联,从而破坏了DNA代谢过程(例如复制),最终导致细胞死亡。 CD19是临床治疗B细胞恶性肿瘤的有效靶标。
为了评估Loncastuximab tesirine三线或三线以上治疗复发/难治性DLBCL患者的疗效和安全性,Ⅱ期多中心、开放标签的单臂临床试验LOTIS 2纳入相关患者,并于 2020年6月在欧洲血液学协会第25届虚拟会议(摘要S233)上报告了成熟数据。至截止日期,Loncastuximab tesirine的总缓解率为48.3%(70/145),完全缓解率为24.1%(35/145)。耐受性可控制,最常见的、发生率≥10%的、≥3级的、治疗中出现的事件为中性粒细胞减少(25.5%,发热性中性粒细胞减少为3.4)、血小板减少(17.9%)、γ-谷氨酰转移酶增高(16.6%)和贫血(10.3%)。Loncastuximab tesirine也正在LOTIS 3和LOTIS 5中接受评估。
伊立替康脂质体注射液二线单药治疗SCLC
FDA批准了伊立替康脂质体注射剂二线治疗SCLC(一线含铂方案治疗失败)的快速通道资格。目前,美国和欧洲已经批准氟尿嘧啶联合亚叶酸钙注射剂治疗吉西他滨类药物治疗后疾病进展的、转移性胰腺腺癌。
一项正在进行的Ⅲ期随机试验(RESILIENT)在评估伊立替康脂质体注射剂单药二线治疗SCLC患者的有效性和安全性。
Eprenetapopt治疗TP53突变型AML
FDA授予Eprenetapopt(也称APR-246)快速通道资格治疗TP53突变AML患者。该药曾获突破性疗法、孤儿药和快速通道资格,用于治疗TP53突变型骨髓增生异常综合征(MDS)。
Eprenetapopt是一种小分子药物,可通过恢复野生型p53构象和功能来再度活化突变的和失活的p53蛋白,从而诱导人类癌细胞的程序性细胞死亡;其对多种实体瘤和血液系统癌症(包括MDS,AML和卵巢癌等)有临床前的抗肿瘤活性。此外,Eprenetapopt与传统的抗癌药物(例如化疗),以及新型机制型抗癌药物和免疫肿瘤检查点抑制剂的联合,均有强大的协同作用。
除临床前实验外,Eprenetapopt的Ⅰ/Ⅱ期临床已经均证明其良好的安全性,以及在血液系统恶性肿瘤和TP53基因突变的实体瘤中的生物学和临床活性。

Zanidatamab获胆管癌突破疗法资格
FDA基于正在进行的、在局部晚期/不可切除和/或转移性HER2表达肿瘤(包括胆管癌)患者中进行的临床试验,授予Zanidatamab突破性治疗资格,用于经治的、HER2基因扩增的胆管癌。
Zanidatamab是一种双特异性抗体,可以同时结合HER2两个非重叠表位(双互补位结合)。这种独特的设计可产生多种作用机制,包括双重HER2信号阻断、增加的结合、从细胞表面去除HER2蛋白和导致抗肿瘤活性的强效应器功能。Zanidatamab正在全球多个Ⅰ期、Ⅱ期和登记处支持的临床试验中接受研究,用于靶向治疗表达HER2的实体瘤患者。
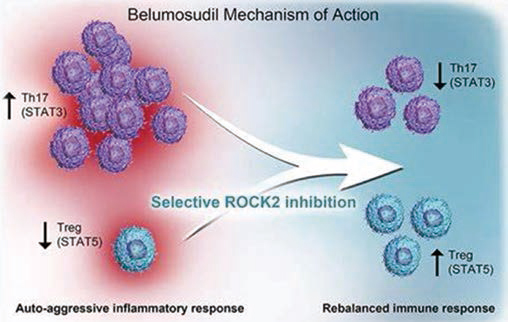
Belumosudil治疗慢性移植物抗宿主病
FDA基于ROCKstar(KD025-213)数据优先审查批注Belumosudil(KD025)治疗慢性移植物抗宿主病患者,审查期为6个月,PDUFA目标日期为2021年5月30日。
Belumosudil是一种ROCK2抑制剂(ROCK2是调节炎症反应和纤维化过程的信号传导途径),曾被FDA批准为二线或二线以上系统治疗失败的慢性移植物抗宿主病的“突破性疗法”,以及慢性移植物抗宿主病的孤儿药。
正在进行的开放性试验ROCKstar(KD025-213)纳入了二线或二线以上系统治疗失败的慢性移植物抗宿主病患者,随机分予Belumosudil 200 mg qd或200 mg bid,每组招募66例患者。主要终点为总缓解率。入组2个月后的期中分析达到了总缓解率终点。在研究完成后6个月的初步分析中,Belumosudil的总缓解率分别为73%和74%,且耐受性良好,不良事件与预期一致。
Infigratinib治疗胆管癌
FDA接受了Infigratinib(口服FGFR1-3选择性抑制剂)治疗胆管癌患者的新药申请,且为优先审批。Infigratinib是一种口服的、ATP竞争性的、FGFR1-3酪氨酸激酶抑制剂,正在研究治疗FGFR驱动疾病的患者,包括胆管癌和尿路上皮癌。
肢端骨样骨瘤治疗设备
11月27日,FDA批准Sonalleve MR-HIFU系统治疗肢端骨样骨瘤。磁共振引导的高强度聚焦超声(MR-HIFU)治疗是一种图像引导技术,结合了高强度聚焦超声消融法和超声裂解法处理过程中温度变化的实时监控。
临床结果支持Sonalleve MR-HIFU系统在消融痛性骨样骨瘤方面可能有益处。在一项MR-HIFU治疗9例患者的研究中,未见技术困难或严重的不良事件。治疗4周的疼痛评分显著降低,其中8例不需止痛药。
(编译 王锡忠)














