FDA加速批准Dostarlimab-gxly用于dMMR的子宫内膜癌
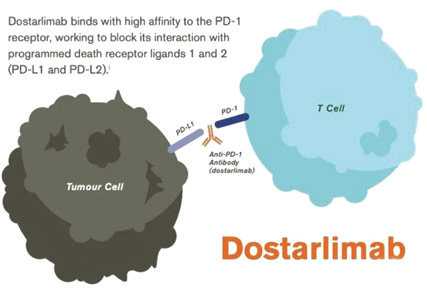
4月22日,美国食品药品监督管理局(FDA)加速了Dostarlimab-gxly(Jemperli)的批准,用于错配修复缺陷(dMMR)的复发或晚期子宫内膜癌的成年患者,这些患者在既往的含铂治疗方案中或之后疾病进展。
GARNET试验
在GARNET试验(美国临床试验登记官网,NCT02715284)中,根据队列A1评估了疗效,该试验是一项针对晚期实体瘤患者的多中心、多队列、开放标签试验。有效人群由71例dMMR复发或晚期子宫内膜癌患者组成,这些患者在含铂治疗方案中或之后疾病发展。患者每3周静脉给予500 mg Dostarlimab-gxly,共4剂,然后每6周静脉给予1000 mg。
主要疗效终点为总缓解率和缓解持续时间,根据《实体瘤反应评估标准 1.1版》,通过盲态独立中央评估。
确认的总缓解率为42.3%(95%CI 30.6%~54.6%);完全缓解率为12.7%,部分缓解率为29.6%。未达到中位缓解持续时间,持续时间≥6个月(2.6~22.4个月,最后一次评估正在进行)的患者占93.3%。
有34%接受Dostarlimab-gxly治疗的患者发生了严重的不良反应。在> 2%的患者中,严重的不良反应包括脓毒症、急性肾损伤、尿路感染、腹痛和发热。最常见的不良反应(≥20%)为疲劳/乏力,恶心,腹泻,贫血和便秘。
最常见的3~4级不良反应(≥2%)为贫血和转氨酶升高。该药物可引起免疫介导的不良反应,包括肺炎、结肠炎、肝炎、内分泌病和肾炎。
推荐的Dostarlimab-gxly剂量和时间(剂量1~4)为每3周500 mg;随后的剂量(从剂量4后的3周开始)为每6周1000 mg,直至疾病进展或出现不可接受的毒性。Dostarlimab-gxly应在30分钟内以静脉输注的形式给药。
(编译 任思雨)


