研究发现黑色素体免疫逃逸机制
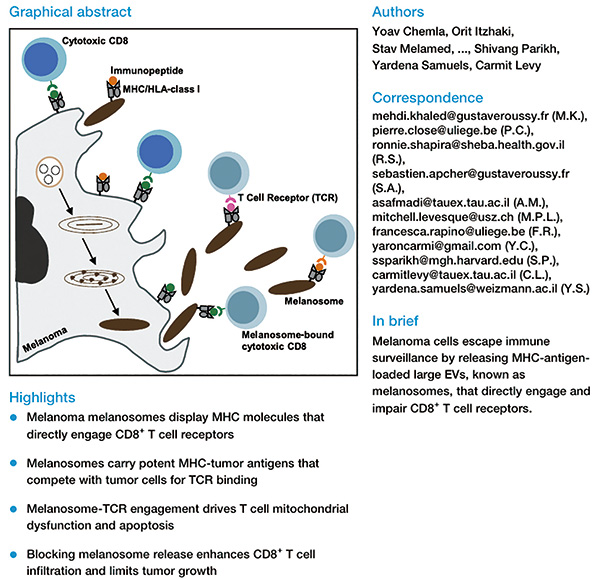
以色列研究者Chemla等研究发现,黑色素瘤特有的大型细胞外囊泡,黑素体(Melanosomes),可携带主要组织相容性复合体(MHC),通过T细胞受体(TCR)主动激活CD8阳性T细胞,导致T细胞功能障碍和凋亡。这是一种全新的免疫逃逸机制,通过抑制黑素体分泌能有效增强抗肿瘤活性。(Cell. 2026年1月8日在线版)
严格来讲,黑素体不算是细胞外囊泡,它是黑素细胞特有的一种细胞器,参与合成、储存和转运黑色素。在将黑色素转移到角质形成细胞的过程中,黑素体以囊泡形式存在于胞外空间,这个转移过程与外囊泡释放/摄取机制有相似之处。
在黑色素瘤中,黑素体积极参与肿瘤微环境塑造、免疫调控和转移,黑素体携带的各种蛋白质、脂质、miRNA起不少作用。此前研究发现,黑色素瘤产生的黑素体可驱动成纤维细胞转化、调节肿瘤相关巨噬细胞多样化、参与耐药等,但该研究首次发现黑素体能直接调控T细胞。
研究者分析了69份转移性黑色素瘤样本,发现免疫治疗效果较差的患者中,携带色素的T细胞比例显著更高,这些T细胞体积也更小,与T细胞耗竭表型一致。研究者由此猜测,黑素体或可直接与肿瘤微环境中的淋巴细胞相互作用并损害其功能。
研究者分离了患者组织样本中的黑素体,与T细胞共孵育,发现黑素体可在30分钟内结合CD8阳性T细胞,每个T细胞能结合1~4个黑素体,并在4小时内保持稳定。单个黑色素瘤细胞每天能分泌约40个黑素体。
研究者估算,黑素体与CD8阳性T细胞的结合类似免疫突触形成,且比CD8阳性T细胞与黑色素瘤细胞之间的相互作用更高效。结合黑素体后,T细胞功能受显著影响,分泌的干扰素γ(IFNγ)和颗粒酶B显著减少,细胞毒性和抗肿瘤活性降低。
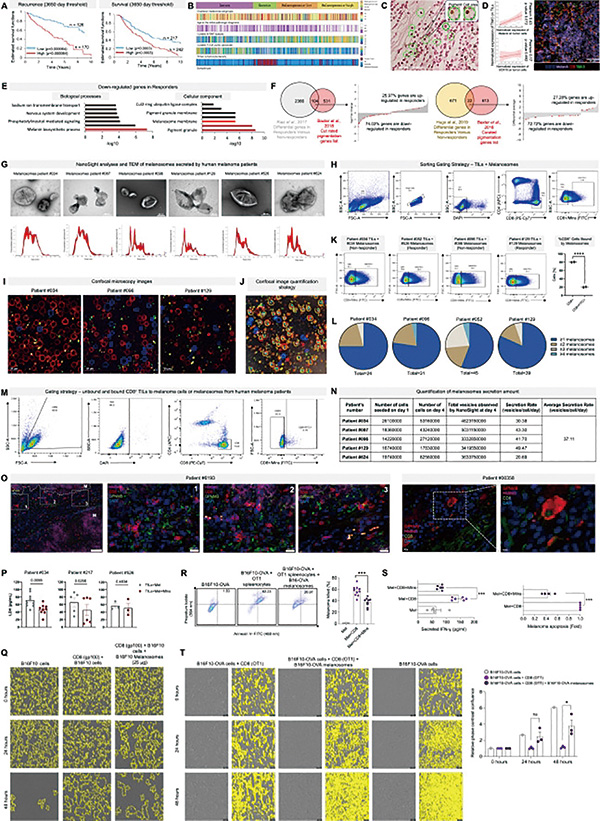
研究者对比了黑色素瘤分泌的黑素体和来自正常黑素细胞的黑素体,发现前者富集MHCⅠ类抗原呈递通路。研究者在电镜下观察了黑素体与CD8阳性T细胞的相互作用,确认二者通过MHC-TCR结合。
研究者分析黑素体发现,其中装载着大量的肿瘤相关抗原和新抗原,这使得黑素体能与黑色素瘤细胞竞争与CD8阳性T细胞结合的机会,阻碍CD8阳性T细胞直接接触黑色素瘤细胞。
而黑素体与CD8阳性T细胞接触后,T细胞转录组较正常激活的T细胞存在差异,虽IFNγ信号略上调,但TCR信号显著减弱,线粒体功能下降,T细胞凋亡增加,未见经典耗竭标志物(PD-1、TIM-3、LAG-3、41BB)表达,呈现功能障碍的状态。使用药物抑制黑素体分泌,可显著促进CD8阳性T细胞浸润,增强T细胞活性,抑制肿瘤生长。
黑素体能上调T细胞IFNγ的mRNA表达,却不增加蛋白分泌。研究者猜测,这可能与耗竭或慢性炎症状态下常见的转录后调控机制有关,也可能类似NK细胞中IFNγ转录本在细胞核内滞留、需要其他细胞因子刺激才能释放的现象。具体机制有待研究。 (编译 王羽蒙)


