研究揭示肿瘤-大脑通讯调控抗肿瘤免疫机制
美国宾夕法尼亚大学金橙橙与耶鲁大学常瑞等发现,肺腺癌会主动接入交感神经,促使其向大脑传递错误信号,加强交感神经释放去甲肾上腺素(NE),营造抑制性免疫微环境。(Nature. 2026年2月4日在线版)
身体与大脑之间的信息交流在维持组织稳态和机体平衡中发挥重要作用,近年来,神经系统在肿瘤中的作用引起关注。实体肿瘤中普遍存在神经纤维浸润,肿瘤神经化程度越高,预示更差的肿瘤预后。大脑能否感知外周器官中的肿瘤,这种肿瘤大脑通讯如何影响抗肿瘤免疫。
该研究综合应用肺组织透明化与三维成像、遗传学与病毒示踪、单细胞转录组学、多层级神经环路操控及免疫功能解析等多种技术手段, 首次系统性揭示了肿瘤与大脑之间存在双向通讯。肿瘤通过感觉神经向大脑汇报信息,大脑通过交感神经反向重塑肿瘤免疫微环境,抑制抗肿瘤免疫反应,促进肿瘤进展。
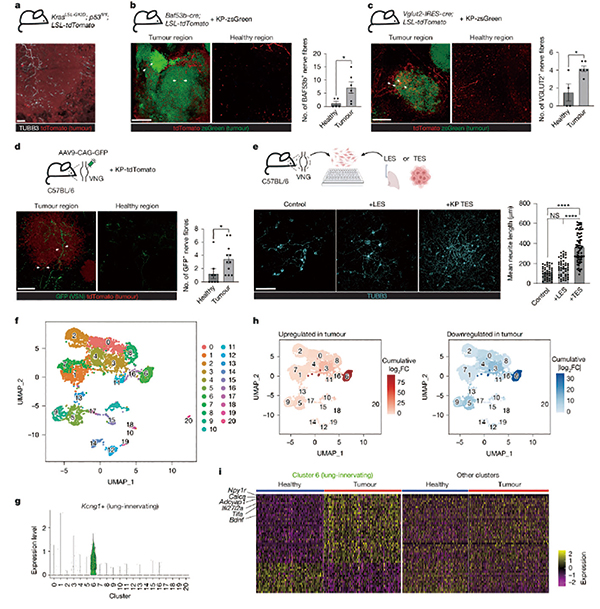
研究者在Kras G12D和Trp53缺失驱动的肺腺癌小鼠(KP小鼠)中通过三维组织透明化成像与神经示踪技术发现,肺腺癌肿瘤团块内部被大量TUBB3+神经纤维穿透并包裹,神经密度显著高于周围正常肺组织。遗传学标志与 AAV 介导的神经末梢示踪定位肿瘤中富集的神经主要为来源于迷走神经结节( vagal nodose ganglia )的 VGLUT2 + 感觉神经 。 体外功能实验发现,肿瘤细胞通过分泌神经营养因子(如 NGF),促进这类感觉神经的末梢生长,使其成为连接肿瘤与中枢神经系统的重要感知节点。
实验证实,肿瘤细胞分泌了神经生长因子等物质,诱导迷走神经向瘤内生长,并使其重编程,感觉神经功能、免疫反应和神经生长等相关基因表达显著上调。
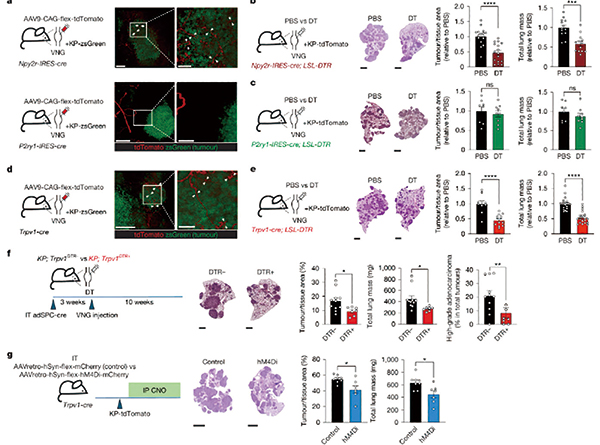
进一步分析锁定了高表达 NPY2R/TRPV1的感觉神经元亚群,它们选择性地进入肿瘤组织,并在肿瘤存在时发生显著的转录重编程。使用遗传或药物方法特异性消融NPY2R/TRPV1+迷走神经,或抑制其神经活动,可显著抑制肿瘤生长,显著延长动物生存期。采用RTX 化学去神经化及 DREADD 介导的化学遗传学抑制,对同一神经亚群进行功能干预,获得一致的抑瘤表型。
NPY2R/TRPV1+迷走神经的促肿瘤作用是通过抑制T细胞实现的。研究者观察到,NPY2R/TRPV1+迷走神经可促使肺泡巨噬细胞变成免疫抑制表型,从而抑制T细胞功能。
由于实验中观察到NPY2R/TRPV1+迷走神经与免疫细胞在空间上紧密相邻,研究者首先猜测迷走神经可能直接调控免疫反应。
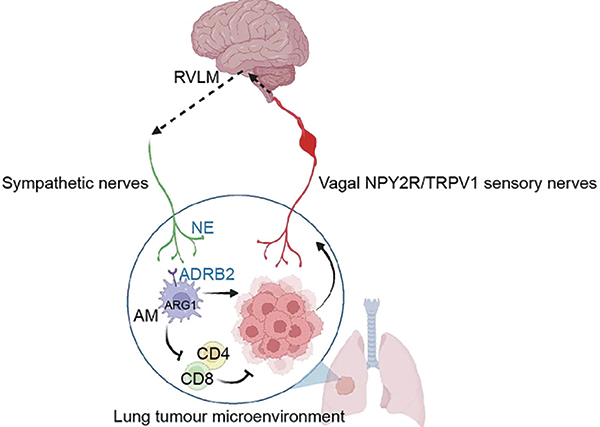
NPY2R/TRPV1+迷走神经释放的神经肽CGRP与免疫功能无关,研究者由此确定这条促癌通路并非迷走神经的局部作用。研究者观察到了肺→迷走神经结节(VNG)→脑干孤束核(NTS)→前外侧延髓(RVLM)这条神经回路的激活。
RVLM激活后,增强了外周交感神经输出,致使肿瘤周围的神经纤维密度升高,分泌更多去甲肾上腺素(NE)。而NE与免疫细胞,尤其是肺泡巨噬细胞表面的β2受体(ADRB2)相互作用,使其进入免疫抑制表型。
研究者分析了公开的癌症基因组图谱数据集,确实发现临床上也存在交感神经基因特征显著的患者,生存较差、CD8+ T细胞反应较弱的现象,与动物实验结果相符。提示肺腺癌主动招募迷走神经进入瘤内,劫持了迷走神经→RVLM这条负责内脏感知的稳态调节通路,利用它促成了免疫抑制微环境,从而助自己生长。
这条通路也给我们提供了治疗靶点。通过遗传或药物手段破坏迷走神经→RVLM→巨噬细胞ADRB2这条通路上的任一节点,均能有效抑制肺腺癌生长。临床上β受体阻滞剂已被证实可提升非小细胞肺癌患者的生存率,也为该研究结果提供了佐证。
该研究系统阐明了肺腺癌与神经系统之间的双向通信机制,首次揭示肺肿瘤可通过分泌神经营养信号激活感觉神经的结构与功能重塑,并经由脑干中枢回路激活交感神经输出,从而通过 β2-肾上腺素能信号诱导巨噬细胞分化,抑制抗肿瘤 T 细胞免疫反应。
在解剖、分子及功能层面构建了一条完整的“肿瘤–感觉神经–中枢–交感神经–免疫”调控轴,为理解神经系统在肿瘤免疫调控中的主观能动作用提供了关键实验证据,也为靶向神经–免疫互作以实现干预实体瘤进展提供了新的理论基础和潜在治疗思路。
(编译 张媛媛)


