研究发现致免疫治疗效果随机的T细胞亚群
美国国家癌症研究所Altan-Bonnet等发现,一组被称为Spark T细胞的极稀有T细胞亚群,是肿瘤免疫治疗效果随机的决定性因素。Spark T细胞数量稀少,但功能性极强,可启动大规模抗肿瘤免疫反应。Spark T细胞的出现具有高度随机性,符合泊松分布,意味着即使在治疗方法一样、免疫系统条件、肿瘤微环境均一致的情况下,免疫治疗的效果并不完全可控,正如研究者所说免疫治疗的效果本质是随机的。(Cell. 2026年2月5日在线版)
此前有研究发现,抗肿瘤免疫由极少数高功能T细胞克隆驱动。抗肿瘤免疫反应由极低频、极高功能性的Spark T细胞驱动,这类细胞可启动大规模抗肿瘤免疫反应。
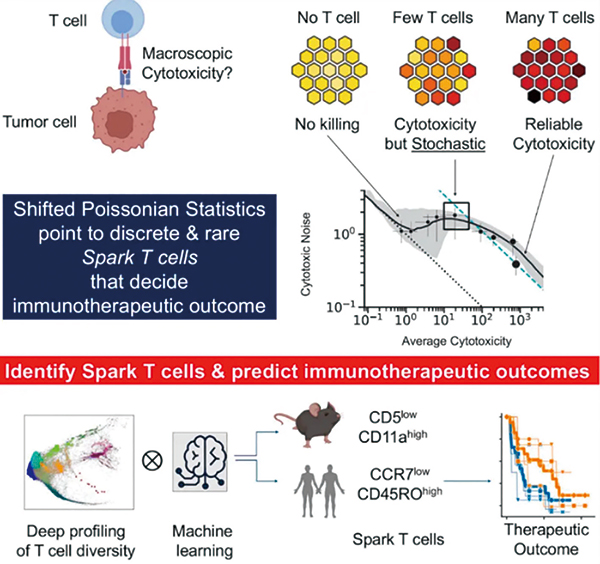
该研究的研究者进行了大量体外免疫测定试验,在微孔中放入癌细胞与单克隆初始CD8+T细胞,在高度受控的环境下观察T细胞介导的癌细胞杀伤。在几乎完全一致的起始条件下,杀伤效果的变异性却非常大(变异系数CV>0.6),远大于化疗药物或细胞毒性因子诱导的杀伤(CV<0.2)。
分析发现,这种随机性来源于 T 细胞激活阶段的差异,T细胞活化具有非常高的随机性(CV>1),有些微孔中含有数百个活化的T细胞,有些微孔中却完全没有。IFN-γ分泌和癌细胞MHCⅠ上调也呈现同样的高变异性,且它们之间高度正相关,提示随机性的来源是一致的。
进行数学拟合后,研究者发现,T细胞活化事件呈现出一种“平移泊松(shifted Poisson)”关系,变异性较纯泊松过程放大两个数量级。研究者猜测,存在一类低频但关键的T细胞亚群,分布服从泊松分布,它们激活后可以带动周围的T细胞同步活化。这组细胞就是Spark T细胞。实验和数学模型显示,IFN-γ介导的MHCⅠ上调是将稀有Spark T激活放大为群体级免疫反应的核心步骤。
研究者开发了一套名为 Sto/CS 的单细胞随机性分析流程,用于识别Spark T细胞,Spark T细胞在激活前处于前体状态(Tproto-spark),此时它们就已经处于高度预激活状态,可随时产生IFN-γ。
分析发现,Spark T 细胞仅占全部 T 细胞的 1/2500 至 1/1000。这些细胞在识别肿瘤细胞后,能迅速产生大量 IFN-γ,进而通过正反馈循环激活周围更多的 T 细胞,最终形成对肿瘤细胞的大规模免疫攻击。
小鼠实验证实,Tproto-spark在不同的TCR转基因品系中均存在,呈现CD5⁺low CD11a⁺high表型,频率差异很大。对人类供者来源的T细胞进行分析,研究者确定人类Tproto-spark表型为CCR7⁻CD45RO⁺。不同供者之间,
Tproto-spark频率差异巨大,对免疫激活强度有决定性影响。
研究者分析了13个免疫检查点抑制剂治疗队列数据,发现Tproto-spark特征可预测含抗CTLA-4疗法的预后,尤其在MHClow(TAP2/B2M低表达)肿瘤中可高度准确预测疗效和生存。
富集或扩增 Spark T 细胞可能成为新一代细胞治疗的方向。通过提高治疗产品中 Spark T 细胞的比例,可能显著增强过继 T 细胞疗法的效果。
该研究显示,Spark T细胞是一种稀有的、高功能的、可启动大规模免疫反应的细胞,由于Spark T细胞具有高度随机性,免疫治疗效果也就表现出了随机性。
(编译 张媛媛)


