研究发现CD48为肝癌免疫逃逸巨噬细胞检查点
第四军医大学李萌等研究发现,CD48是肝细胞癌肿瘤相关巨噬细胞表面一个全新的功能独立的免疫检查点分子。在肿瘤相关巨噬细胞中,CD48不依赖于经典配体CD244,通过与MMP14形成顺式相互作用,激活RAP1-YAP-STAT3信号轴,驱动巨噬细胞向免疫抑制表型程序性重编程,从而促进肿瘤进展并介导PD-1抑制剂耐药。靶向CD48能有效逆转免疫抑制微环境、重启T细胞功能,并与PD-1抑制剂产生强效协同作用。(Gut. 2026年1月2日在线版)
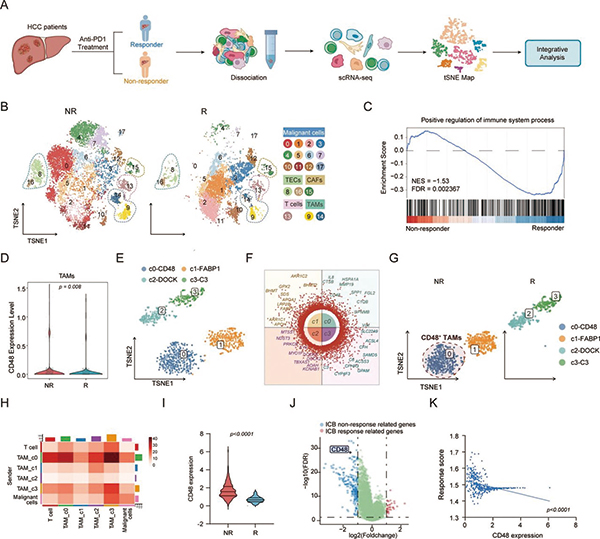
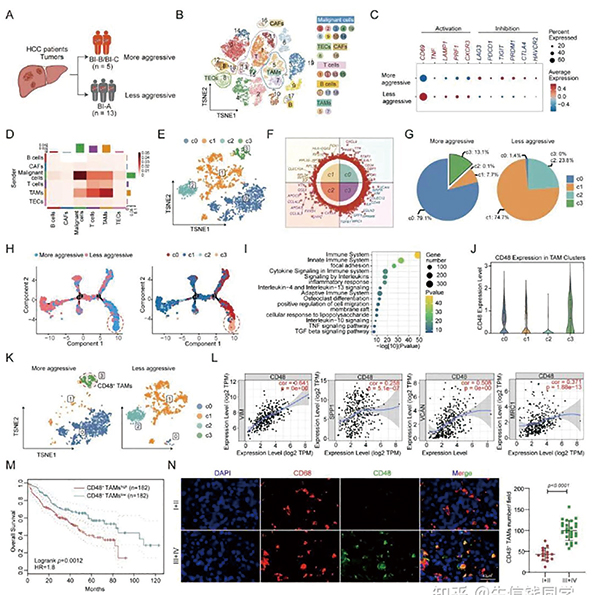
研究者首先对单细胞测序数据进行分析,将患者肿瘤分为高、低侵袭性两组,发现高侵袭性肿瘤中T细胞普遍耗竭,而肿瘤相关巨噬细胞(TAM)与肿瘤细胞、T细胞的交互最为活跃,提示其是免疫抑制的关键枢纽。进一步分析后,研究者锁定了一个几乎只存在于高侵袭性肿瘤中的亚群(c3),高表达大量免疫抑制和促转移基因,膜蛋白CD48是该亚群最显著的上调标志之一。
临床队列分析证实,CD48+TAM的富集与患者不良预后、肿瘤分期进展以及CD8+T细胞浸润减少密切相关。对免疫治疗患者样本的分析更直接地显示,治疗无应答者的巨噬细胞上CD48水平显著高于应答者。这些发现提示,CD48是介导肝癌免疫抑制和耐药的关键TAM亚群标志物。
功能实验证实了CD48的关键作用。体外实验表明,敲除CD48能使巨噬细胞在极化时趋向于促炎的M1型,同时显著削弱其M2型相关的免疫抑制分子IL-10、TGF-β和促转移蛋白MMP9的表达。对于已经是M2型的巨噬细胞而言,CD48缺失会使其失去抑制CD8+T细胞的能力,从而促进CD8+T细胞的活化与肿瘤杀伤功能。
研究者构建了全身敲除和巨噬细胞特异性敲除 CD48 的小鼠模型。肝癌小鼠模型中,无论是全身性还是巨噬细胞特异性敲除CD48,均能有效抑制肝癌移植瘤生长和肺转移,并显著增强PD-1抑制剂的效果。肿瘤微环境分析显示,CD48缺陷导致TAM向抗肿瘤表型重编程,并伴随CD8+T细胞功能的重振。CD48 缺失可重编程巨噬细胞表型,增强 M1 型巨噬细胞标志物表达,同时降低 M2 型标志物水平,并显著提升 CD8+ T 细胞的活化、增殖和细胞毒性功能。
CD48是没有胞内结构域的膜蛋白,如何向细胞内传递信号,经典通路是通过与表达在T细胞或NK细胞上的CD244结合来发挥免疫调节作用。该研究发现巨噬细胞本身几乎不表达CD244,且T细胞上CD244的缺失并不影响CD48对巨噬细胞功能的调控,CD48通过与膜型基质金属蛋白酶 14(MMP14)形成顺式复合物,激活 RAP1-YAP-STAT3 信号通路,独立于经典的 CD48-CD244 相互作用。
结合免疫共沉淀与质谱技术,研究者发现CD48是通过与MMP14形成高亲和力的顺式相互作用来启动信号。两者结合后,激活小G蛋白RAP1,进而通过FAK/YAP通路促使转录因子STAT3入核并活化。活化的STAT3驱动IL-10、TGF-β1、MMP9等免疫抑制和促转移基因的表达,完成巨噬细胞的促肿瘤极化。STAT3还能反过来促进CD48转录,形成一个自我强化的正向反馈环路,持续放大免疫抑制信号。
研究者开发了抗CD48单克隆抗体。治疗潜力探索显示,抗 CD48 单克隆抗体治疗能有效抑制肝癌进展,且与 PD1 抑制剂联合使用时展现出显著协同效应。在肝癌小鼠模型中,抗CD48治疗有效抑制了肿瘤生长和转移,并显著重塑了免疫微环境,表现为促使TAM向免疫激活表型转化,并增强CD8+T细胞的效应功能。抗CD48抗体与PD-1抑制剂联用展现了强大的协同抗肿瘤效果,疗效显著优于单药治疗。初步安全性评估显示,该疗法在小鼠中未引起明显系统性毒性。CD48 阻断治疗未引起明显的全身免疫紊乱,主要脏器功能和血液学指标均维持正常,展现出良好的临床转化潜力。
该研究将CD48明确为肝癌相关巨噬细胞上的新型免疫检查点,CD48通过非经典的机制对巨噬细胞进行重编程、诱导其向免疫抑制表型转化,为助力肝癌免疫治疗提供了新的方案。
(编译 张媛媛)