国人发现调节性T细胞利用氨发挥免疫抑制功能
徐州医科大学附属医院/南京医科大学第一附属医院吕凌和古鉴研究团队,发现调节性T细胞竟会利用氨发展壮大,在富含氨的肿瘤微环境中,除了调节性T细胞外,CD8阳性等T细胞均难以活命。分析背后机制后发现,肿瘤微环境中的氨会激活调节性T细胞的尿素循环,这不仅可帮调节性T细胞解氨毒,还能促进调节性T细胞的生长和免疫抑制功能。(Cell. 2025年12月24日在线版)
肿瘤细胞在被PD-1抑制剂杀死之后,会释放氨,进一步强化调节性T细胞的功能,打造免疫抑制微环境,导致肿瘤对免疫治疗耐药。有研究发现免疫治疗后调节性T细胞会往肿瘤内聚集。
肿瘤微环境积累了多种有害有毒代谢产物,如乳酸和氨等。在这些代谢产物的影响下,抗癌的CD8阳性T细胞要么处于耗竭状态、要么难以生存;然而,也有些免疫抑制性细胞在肿瘤微环境中存活很好,如调节性T细胞等。
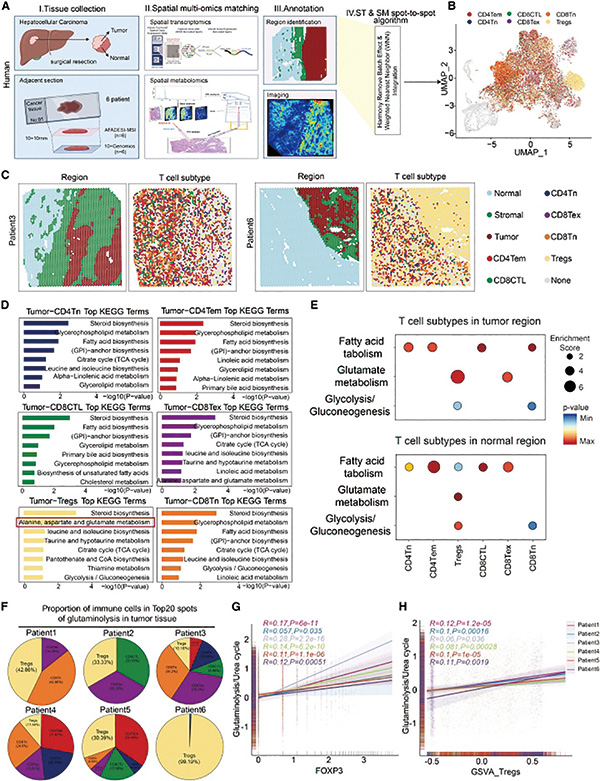
研究者在分析肝癌微环境之后发现,肿瘤组织中的调节性T细胞含量确实高。在分析肿瘤组织的空间转录组学与空间代谢组学数据后,研究者注意到,谷氨酰胺分解是调节性T细胞富集区域特有的代谢特征。
谷氨酰胺分解是肿瘤细胞获取能量和生物合成前体的关键代谢过程。在这个代谢过程中,有一种重要代谢产物氨。若调节性T细胞聚集在谷氨酰胺分解水平高的肿瘤区域,说明它们可能利用了这个过程中的某种代谢产物。
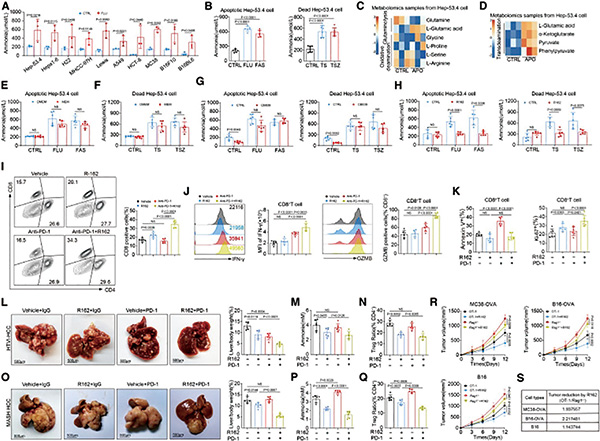
基于肝癌小鼠模型的研究显示,瘤内氨含量与调节性T细胞丰度之间呈现强烈的正相关。在给小鼠注射谷氨酰胺拮抗剂后,可见肿瘤进展受到抑制,同时伴随氨水平和调节性T细胞浸润水平降低。提示吸引调节性T细胞的,有可能是有害代谢产物氨。
研究者在体外和体内研究了氨对调节性T细胞的影响,发现肿瘤间质水平的氨(5 mM)对调节性T细胞的数量无影响,但显著抑制CD8/CD4阳性T细胞增殖。更高浓度氨(10 mM和20 mM)对所有T细胞亚群均有抑制作用,但对CD8/CD4阳性T细胞的抑制效应更大。低浓度氨还促进调节性T细胞FOXP3、PD-1和CTLA-4表达水平升高。提示调节性T细胞不仅能适应瘤内氨,氨还会增强其免疫抑制作用。
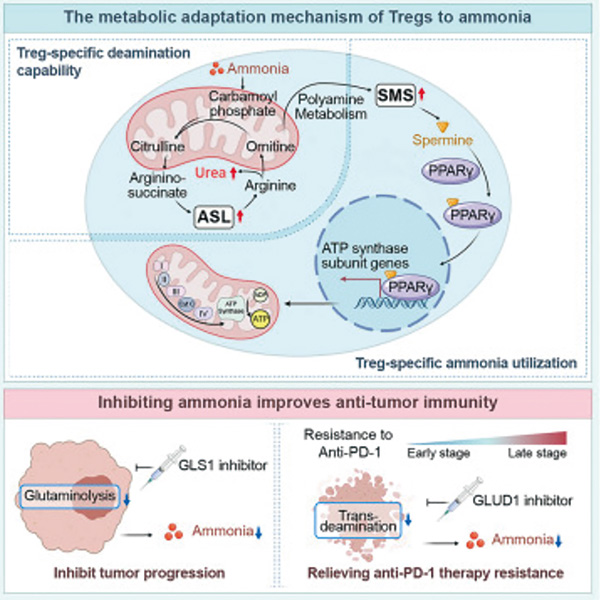
后续机制研究发现,氨的存在会促进类固醇受体共激活子3(SRC3)与调节性T细胞中特异性存在的信号转导与转录激活因子3(STAT3)相互作用,促进精氨基琥珀酸裂解酶(ASL)编码基因的转录,提升ASL水平,驱动调节性T细胞的尿素循环。尿素循环产生的代谢产物会促进调节性T细胞的氧化磷酸化和免疫抑制活性。
有诸多研究发现,使用PD-1/PD-L1抑制剂后,肿瘤微环境中调节性T细胞数量会增加,考虑到免疫治疗期间肿瘤代谢会发生显著变化,研究者推测这些代谢改变可能促进瘤内调节性T细胞的富集。
分析接受PD-1抑制剂治疗的肝癌患者肿瘤样本发现,肿瘤组织中氨水平升高,同时肿瘤浸润调节性T细胞也相应增加。至于癌细胞死亡时释放氨的原因,不是由于谷氨酰胺分解代谢,而是由于谷氨酸经转氨基作用转化为α-酮戊二酸的过程,只要抑制谷氨酸脱氢酶(GLUD),即可减少这个过程中氨的产生。
基于肝癌小鼠模型的研究发现,GLUD抑制剂可逆转肿瘤对PD-1抑制剂的耐药。单独抑制GLUD1即可发挥抗肿瘤活性,并抑制调节性T细胞的积累。在多种肿瘤模型中,GLUD1抑制均表现出抑制效果,且与PD-1抑制剂联合使用时,抗肿瘤效果从33.1%提升至63.2%。这些发现为靶向GLUD1的潜在临床转化及其治疗价值提供了证据支持。
该研究揭示了调节性T细胞适应肿瘤微环境恶劣环境的机制,为靶向调节性T细胞的免疫疗法提供了新思路。 (编译 王羽蒙)