国人研究发现铁死亡肿瘤细胞特征
广州医科大学附属第三医院柳娇和上海交通大学医学院附属胸科医院王佳谊,及美国得克萨斯大学西南医学中心唐道林和法国索邦大学Guido Kroemer联合领衔研究团队,发现近年来在抗肿瘤领域被寄予厚望的铁死亡,与其他死亡方式相比免疫原性较低,铁死亡的肿瘤细胞激活抗肿瘤免疫的能力较差。(Cell. 2026年1月5日在线版)
在探索潜在机制后,研究者发现铁死亡的癌细胞会释放铁死亡抑制因子GPX4,GPX4随后作用于抗原呈递细胞——树突状细胞,抑制树突状细胞的成熟和活化,最终导致抗肿瘤T细胞无法启动抗肿瘤能力。
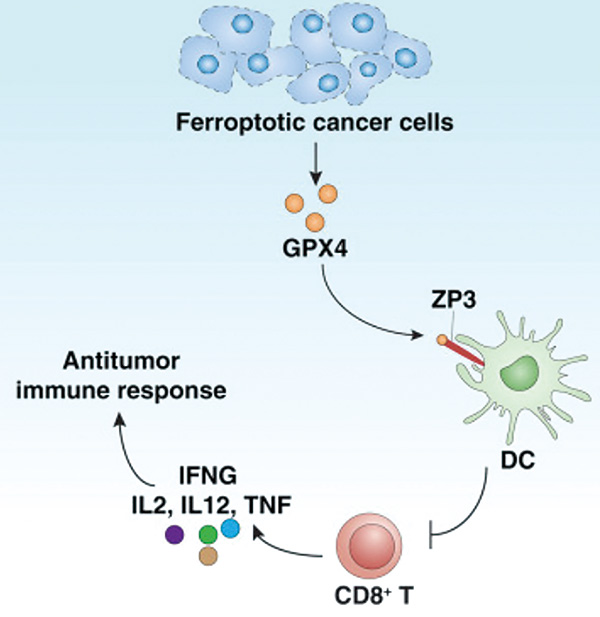
GPX4原本即为铁死亡抑制因子,可阻止细胞铁死亡,避免抗原释放和免疫活化;一旦GPX4未阻止住铁死亡,便又通过抑制抗原呈递细胞,阻止免疫激活。无论有无遏制铁死亡,GPX4均达到抑制免疫激活的目的。这是学界首次发现铁死亡细胞会释放免疫抑制型损伤相关分子模式(DAMP),改变了我们对铁死亡的认知,也让我们重新思考铁死亡在抗肿瘤领域的应用。
铁死亡因释放损伤相关分子模式,被认为是具有免疫原性的死亡方式。近年来研究发现,铁死亡对抗原呈递细胞带来负面影响,影响适应性免疫反应。探讨铁死亡影响免疫原性的机制,尤为重要。
研究者比较了细胞凋亡、坏死性凋亡、铁死亡和铜死亡的免疫原性,虽然四种死亡方式均释放有免疫激活作用的HMGB1,及有免疫抑制作用的PGE2,但铁死亡的免疫原性最弱,提示铁死亡细胞释放了其他具有免疫抑制性的DAMP。
研究者分析了铁死亡的两个重要抑制因子GPX4和FSP1。在诱导60种人肿瘤细胞系铁死亡后,发现只有GPX4会释放出来。值得注意的是,凋亡、坏死性凋亡或铜死亡细胞不释放GPX4。后续实验证实,铁死亡细胞释放的GPX4确有免疫抑制作用。
之前研究已将铁死亡的弱免疫原性与抗原呈递细胞——树突状细胞联系起来,研究者直接分析了铁死亡细胞对树突状细胞的影响,发现铁死亡肿瘤细胞促进免疫抑制性树突状细胞生成,而GPX4抗体可阻断这一过程,提示GPX4在通过某种方式影响树突状细胞。
在分析能与GPX4结合的蛋白后,研究者发现树突状细胞表面的透明带蛋白3(ZP3)是目标蛋白。无论是沉默还是敲除ZP3编码基因,均可阻断GPX4对树突状细胞的负面影响。在分析上述变化对T细胞的影响时,研究者发现,GPX4确可通过ZP3调节T细胞活化。
研究者在胰腺癌、肺癌和卵巢癌等瘤种中,探讨了阻断GPX4和ZP3结合,对可诱导铁死亡疗法的影响。基于上述细胞系,和不同的化疗或放疗方案,研究者发现了GPX4的释放,及抗ZP3抗体可提升不同化疗方案或放疗治疗效果,抑制GPX4也有类似效果。
研究者分析TCGA数据库后发现,ZP3在18种肿瘤中高表达,且ZP3高表达在9种肿瘤中与较差的生存预后显著相关,包括胰腺癌、肺癌、肾癌、结直肠癌、肝癌、胶质瘤、头颈癌、膀胱癌和前列腺癌。ZP3表达升高与CD8阳性T细胞在肿瘤中的浸润减少相关,提示GPX4–ZP3轴有预测/预后价值。
该研究首次发现铁死亡细胞释放的GPX4,是一种具有免疫抑制作用的损伤相关分子模式,通过抑制树突状细胞的成熟来抑制抗肿瘤免疫。靶向GPX4-ZP3信号通路的药物,或能增强诱导铁死亡疗法以及常规抗癌治疗的疗效。 (编译 王羽蒙)


