研究发现PD-1抗体杀死T细胞
美国Augusta大学Verma等发现,PD-1抗体会作用于没有被肿瘤相关抗原激活或激活不充分的杀伤性T细胞,导致这些细胞功能紊乱,最终抑制有抗肿瘤活性T细胞的抗肿瘤能力,甚至杀死这些能抗癌的T细胞。(Nat Immunol. 2019; 20: 1231-1243. doi: 10.1038/s41590-019-0441-y)
此前有大量研究表明,很多肿瘤患者体内,存在大量未被肿瘤相关抗原激活或激活不充分的杀伤性T细胞。研究者发现,在PD-1抗体治疗同时,如果给荷瘤小鼠足够的抗原刺激,如抗肿瘤疫苗治疗,就可以根除肿瘤对PD-1抗体的耐药性。但在PD-1抗体治疗后再使用抗肿瘤疫苗治疗则无效,甚至连疫苗的抗肿瘤效果也被消解了。
为了探讨解决大部分肿瘤对PD-1抗体的耐药性,研究者尝试将抗肿瘤疫苗与PD-1抗体联合使用。

理论上讲,抗肿瘤疫苗可增加杀伤性T细胞的抗原暴露和激活,而PD-1抗体可解除肿瘤对免疫细胞的抑制,把这两种疗法联合使用,应该可以优势互补。
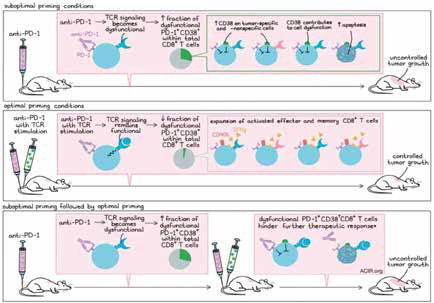
但研究者发现了一个奇怪的现象,给小鼠单独注射PD-1抗体,与不治疗的对照组相比,杀伤性T细胞和抗原特异性杀伤性T细胞均无显著差异,小鼠的肿瘤也无明显改变,因为已经耐药。
给小鼠单独注射抗肿瘤疫苗,小鼠体内的抗原特异性杀伤性T细胞数量增多,提示疫苗发挥了作用,只不过抗肿瘤效果不明显,小鼠肿瘤无显著改变。把疫苗和PD-1抗体同时注射给小鼠,小鼠体内抗原特异性杀伤性T细胞数量就更多了,小鼠存活率明显提高了,提示二者联合是有增效的。
最后一组先注射PD-1抗体,3天后再注射抗肿瘤疫苗,结果小鼠的肿瘤生长失控了,PD-1抗体联合抗肿瘤疫苗完全无效,就像没有接受治疗一样。研究者在其他PD-1抗体耐药的小鼠模型中重复了一遍实验,结果一致。
这些肿瘤对PD-1抗体耐药,很有可能是杀伤性T细胞被抗原刺激不够造成的,这在此后的研究中得到了证实,的确是PD-1抗体影响了没被抗原充分激活的T细胞,导致了肿瘤对PD-1抗体的耐药性。
鉴于激活不充分的T细胞在各瘤种中广泛存在,找到潜在原因,有望解决这一大部分患者的耐药问题。研究者比较了只用抗肿瘤疫苗、疫苗与PD-1抗体同时使用、先用PD-1抗体再用疫苗三种情况下,小鼠体内T细胞的差异,发现在疫苗之前使用PD-1抗体,导致小鼠体内总T细胞和抗原特异性T细胞的凋亡性死亡增加,这种凋亡可以持续到疫苗注射后13天,多种肿瘤模型中均可观察到这一现象。
研究者还发现,T细胞的凋亡不是PD-1抗体激活最终诱导的细胞死亡,而极有可能是PD-1信号与TCR信号的串扰,导致T细胞功能紊乱,最终走向死亡。
两年前有研究者在PD-1抗体耐药的肿瘤中发现了一类CD38高表达的PD-1阳性杀伤性T细胞,进一步分析研究者发现,疫苗治疗前接受PD-1抗体,确会导致T细胞CD38表达增加,无论总T细胞还是抗原特异性T细胞,CD38表达都增加,且这些T细胞即使在被抗原激活后,也不能产生INF-γ。
同时使用疫苗和PD-1抗体,CD38表达水平会下降,PD-1阳性CD38高表达的抗原特异性T细胞也减少,抗原刺激后,INF-γ大量产生。CD38高表达的T细胞在被抗原刺激后会凋亡。
研究者在一个肿瘤患者队列中验证了这些发现,相比PD-1抗体治疗效果好的患者,PD-1抗体治疗无效的患者体内CD38高表达杀伤性T细胞明显高很多。所有PD-1抗体治疗无效的患者肿瘤微环境中CD38高表达杀伤性T细胞都大于4%;而只有25%的PD-1抗体治疗效果好的患者体内有这么多异常T细胞。
以这个标准来判断PD-1抗体疗效的话,灵敏性达100%,特异性为75%,ROC曲线下面积为0.887。提示CD38高表达杀伤性T细胞有望成为PD-1抗体疗效预测的生物标志物。研究者发现,直接通过血液中单个核细胞(PBMCs)的CD38水平,就可以预测PD-1抗体的治疗效果。
研究者认为,该研究提示,没有被抗原激活,或者激活不充分的CD8阳性T细胞,在接触PD-1抗体之后,会变成CD38高表达的无功能T细胞,使得肿瘤对PD-1抗体产生耐药性。如果在PD-1抗体治疗前,适当地用抗癌疫苗处理,会解除肿瘤对PD-1抗体的耐药性(这也在一定程度上解释了,肿瘤突变负荷高的癌种,更有可能从PD-1抗体治疗中获益)。这个发现也为PD-1抗体联合抗癌疫苗治疗的临床研究,提供了治疗策略:要首先使用抗癌疫苗,或者至少二者同时使用。
(编译 赵佳乐)














