贝达药业自主研发“不限癌种”TRK抑制剂获批临床
近期,贝达药业发布公告称,其自主研发的TRK抑制剂BPI-28592的临床试验已获得国家药监局批准,适应证拟用于不可手术的局部晚期或转移性NTRK基因变异的实体瘤患者,该临床试验申请曾于今年2月14日获得受理。
BPI-28592是一种新型强效、高选择性的原肌球蛋白受体激酶(Tropomyosin receptor kinase,缩写为TRK,又名神经营养受体酪氨酸激酶Neurotrophin receptor kinase,缩写为NTRK)二代口服小分子抑制剂,可覆盖多种癌种,拟用于携带NTRK基因变异的局部晚期或转移性实体瘤患者的治疗。
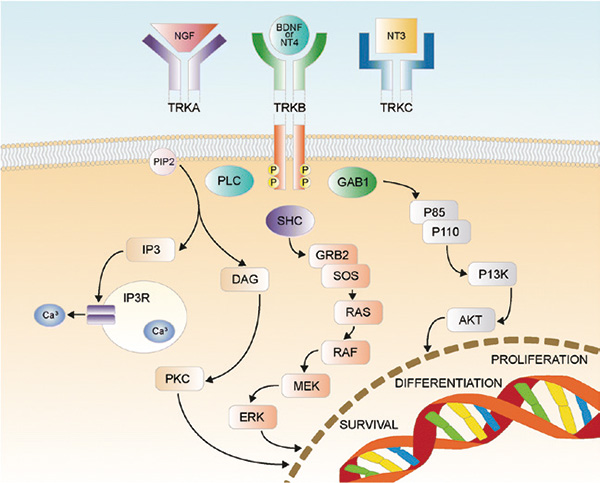
TRK,又名神经营养受体酪氨酸激酶(Neurotrophin receptor kinase,NTRK),是一类神经生长因子受体,包含NTRK1、NTRK2和NTRK3基因编码的TrkA、TrkB和TrkC三种受体。TRK激酶与细胞增殖、分化、代谢和凋亡有密切的关系。研究表明,当染色体变异发生NTRK基因融合,可导致TRK激酶下游信号过度激活,进而可导致癌症产生。
NTRK基因融合可见于多种实体瘤类型中,包括胰腺癌、甲状腺癌、唾液腺癌、乳腺癌、结直肠癌、肺癌等,尤其在一些罕见的癌症,如婴儿纤维肉瘤、类似乳腺分泌性癌、乳腺分泌型癌中,NTRK基因融合的发生率可达90%以上。
临床前数据显示,BPI-28592在动物体内外生物学活性一致,能有效抑制肿瘤细胞增殖,并能对Larotrectinib 耐药的突变如TRKA (G595R)、TRKC(G623R)等有效,有望提供一种新的分子靶向的治疗方法,为NTRK突变的肿瘤患者提供更多益处。
截至目前,FDA已经批准两款小分子TRK抑制剂,分别是Loxo/拜耳共同研发的Larotrectinib和罗氏的Entrectinib,这两款药物也被称为“广谱抗癌药”。其中,Larotrectinib是新一代具备高度特异性的口服TRK抑制剂,同时也是一款从早期开发时期开始就针对特定基因突变,而不针对特定癌症种类的广谱肿瘤药,可用于所有表达有原肌球蛋白受体激酶的肿瘤患者,而不是针对某个解剖位置的肿瘤。
2018年11月,FDA加速批准了Larotrectinib上市,用于治疗无已知耐药突变的,广泛转移或局部手术治疗效果不好的,现有治疗方案进展或无可替代治疗方案的,NTRK基因融合的成人和儿童实体瘤患者。
Entrectinib则是一款针对NTRK和ROS1基因融合而设计的特异性酪氨酸激酶抑制剂,它能抑制TRKA/B/C和ROS1激酶活性,有试验数据表明,Entrectinib缩小了一半以上(57.4%)的NTRK基因融合阳性、局部进展或转移性实体瘤患者的肿瘤,反应时间(DoR)为2.8~26+个月,对乳腺癌、胆管癌、结直肠癌、妇科肿瘤、神经内分泌肿瘤、非小细胞肺癌、唾液腺癌、胰腺癌、肉瘤、甲状腺癌等多种实体肿瘤均有效。
2019年8月,Entrectinib获得美国FDA批准上市,用于治疗没有其他有效治疗方法的、携带NTRK基因融合的成年和儿童实体瘤患者,以及ROS1阳性非小细胞肺癌(NSCLC)患者。
所谓广谱抗癌药,并非可用于治疗所有癌症,相比之前的抗癌药通常只适用于根据发病位置确定的特定类型肿瘤,广谱抗癌药用于根据广谱抗癌药分子标志物筛选出来的合适患者,从而可覆盖相对更多类型的肿瘤。
目前,国内的TRK抑制剂市场仍是空白,上述的两款不限癌种TRK抑制剂均未在中国获批,不过均已申请临床试验,且被CDE受理或批准,Entrectinib去年在中国获批一项临床试验,用于治疗携带ROS1阳性的局部晚期或转移性非小细胞肺癌或NTRK1/2/3基因突变的局部晚期或转移性实体瘤患者,日前再在中国申报三项临床试验,且已获得受理。Larotrectinib则早在去年3月就已获得临床试验默示许可。
(编撰 胡静)


