CinClare研究问鼎JCO: 基因引导下新辅助放化疗将局部晚期直肠癌pCR率翻一番
局部晚期直肠癌的标准治疗模式为卡培他滨为基础的新辅助治疗联合全直肠系膜切除,在此基础上,复旦大学附属肿瘤医院的章真、朱骥教授团队携手全国17个中心历时8年开展了CinClare研究,在UGT1A1基因的引导下,探索了新辅助放化疗同期联合伊立替康的疗效,以期进一步提高局部晚期直肠癌患者的肿瘤退缩率,并使更多的患者获益。CinClare研究结果显示,同期联用伊立替康可将病理完全缓解(pCR)率较标准治疗组提升近1倍,为当前的治疗模式提供了新方案。(J Clin Oncol. 2020年10月29日在线版. doi: 10.1200/JCO.20.01932)
作为新辅助放化疗的联合用药,伊立替康的疗效早已有了相关报道,但由于担心患者的耐受性差而限制了伊立替康的广泛应用。有研究报道,尿苷二磷酸葡萄糖醛酸转移酶1A1(UGT1A1)基因型是影响伊立替康剂量的关键因素。基于UGT1A1基因型区分伊立替康剂量可改善pCR率。因此,CinClare研究旨在探究新辅助放化疗同期联用伊立替康的疗效,这也是首个在UGT1A1基因型指导下,将伊立替康联用于局部晚期直肠癌新辅助放化疗的Ⅲ期临床试验。
CinClare研究是一项在中国17个中心开展的随机、开放标签、多中心的Ⅲ期临床试验。入组标准为:患者年龄在18~75岁之间,经组织病理学确认为直肠腺癌,肿瘤距离肛门≤10 cm,盆腔磁共振(MRI)显示肿瘤的临床分期为cT3~4和/或N+,常规的胸部和腹部CT扫描未见远处转移。其他的纳入标准包括Karnofsky评分≥70;所有患者均接受UGT1A1基因型的检测,并确定基因型为*1*1或*1*28型;骨髓造血功能及肝肾功能正常。
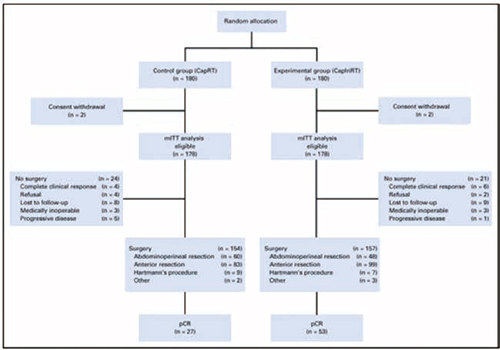
研究方案:对照组(CapRT)接受盆腔调强放疗(50 Gy/25次),同期口服卡培他滨(825 mg/m2,bid,d1~5),放化疗结束后2周采用卡培他滨加奥沙利铂(XELOX)化疗1程(奥沙利铂130 mg/m2,d1,卡培他滨1000 mg/m2,bid,d1~14)。试验组(CapIriRT)接受50 Gy/25次盆腔放疗,同期口服卡培他滨(625 mg/m2,bid,d1~5),每周接受1次伊立替康化疗,并在放化疗完成后2周进行卡培他滨加伊立替康(XELIRI)方案化疗(伊立替康200 mg/m2,d1,卡培他滨1000 mg/m2,bid,d1~14)。
研究者根据患者的UGT1A1的基因型对患者的伊立替康周化疗剂量进行了调整,对于UGT1A1* 1 * 1的患者,伊立替康的剂量为80 mg/m2,而UGT1A1 * 1 * 28型患者的剂量为65 mg/m2。放化疗完成后8周进行手术,术后均采用5个周期的XELOX方案辅助化疗。该试验已在网站上注册,编号为NCT02605265。
2015年11月至2017年12月,我国共17个中心招募了360例患者,4例因撤回知情同意被排除,共356例患者组成了改良的ITT(mITT)人群。CapRT组所有(100%)患者都接受了≥90%的放疗和卡培他滨计划剂量治疗。在CapIriRT组中,有175例(98%)患者接受了≥90%的放疗和卡培他滨计划剂量治疗,125例(70%)患者接受了至少4个周期的伊立替康化疗。
CapRT组和CapIriRT组3~4级毒性反应的发生率分别为6%和38%。两组在放化疗期间最常见的3~4级毒性分别是白细胞减少症(3% vs. 25%),中性粒细胞减少症(2% vs. 20%)和腹泻(2% vs. 13%)。

CapRT组和CapIriRT组各有154例(87%)和157例(88%)患者接受了手术。CapRT组放化疗结束至手术的中位间期为61天(45~104天),CapIriRT组为62天(4~156天)。CapRT组和CapIriRT组患者接受腹会阴联合切除术(APR)的比例分别为39%和31%(P=0.120),两组术后出现3级以上并发症的患者比例相似(11% vs. 15%;P=0.268),手术后60天内均无患者死亡。
CapRT组中有148例患者(96%)接受了根治手术,CapIriRT组有153例(97%),两组分别有7例(5%)和3例(2%)患者的环切缘≤1 mm。CapRT组和CapIriRT组分别有27例(18%)和53例(34%)患者达到了pCR(HR=1.93,P<0.001)。两组的淋巴结阴性率分别为73%和74%。
在mITT人群中,CapRT组的pCR率为15%,CapIriRT组为30%(HR=1.96,P<0.001)。在CapRT组和CapIriRT组中分别有4例和6例患者在达到cCR后选择“观察等待”策略,各有20例和5例患者由于各种原因未进行手术,包括拒绝手术、失访、无法手术或疾病进展。两次敏感性分析均显示主要终点的数据是一致的。
(编译 李海龙 韩佳)
研究解读
CinClare研究是首个探究在局部晚期直肠癌新辅助放化疗中联合卡培他滨和伊立替康剂量的Ⅲ期临床试验。该研究的pCR率从CapRT组的15%增加到CapIriRT组的30%,达到主要研究终点,但值得注意的是3~4级毒性反应的发生率也明显增加(38%),尤其是白细胞减少症(25%)、中性粒细胞减少症(20%)和腹泻(13%)。总体而言,联合伊立替康的新辅助放化疗方案在中国人群中是安全可行的。
伊立替康是一种拓扑异构酶Ⅰ抑制剂。临床前研究表明,伊立替康还可以与放疗联合产生良好的协同作用。但是,既往的Ⅰ/Ⅱ期试验中,新辅助治疗同期联用伊立替康并未增加肿瘤的完全缓解率,究其原因,可能是由于伊立替康的剂量不足所致。有研究显示,接受总伊立替康剂量为240 mg/m2的患者的pCR率为16%~35%,而总剂量为200 mg/m2的患者的pCR率为0。因此,研究者认为伊立替康仅在足够剂量时才可能是理想的放射增敏剂。然而,由于伊立替康毒性限制了其在临床试验中的验证。
有研究报道了UGT1A1基因型影响了伊立替康的最大耐受剂量(MTD),然而缺乏大样本研究的验证。在白人中,UGT1A1* 1 * 1和* 1 * 28基因型的比例分别为46%和39%,而亚洲人群中这一比例分别为80%和16%。白人与亚洲人群中伊立替康的MTD也有显著差别。因此,复旦大学附属肿瘤医院进行了一系列研究,探究UGT1A1基因型引导下新辅助放化疗同期联用伊立替康的剂量。Ⅰ期的剂量爬坡研究确定了* 1 * 1基因型患者的伊立替康MTD高达每周80 mg/m2,* 1 * 28基因型患者的MTD高达每周65 mg/m2。这一剂量明显高于以往研究,也可能是提高pCR率的主要原因。CinClare研究是在此剂量爬坡的基础上进行的Ⅲ期随机对照研究,进一步证明了在UGT1A1基因型引导下新辅助治疗同期联合伊立替康可提升患者的pCR率。














