奥拉帕利组合获FDA批新适应证 HRD 阳性者无进展生存期37.2个月
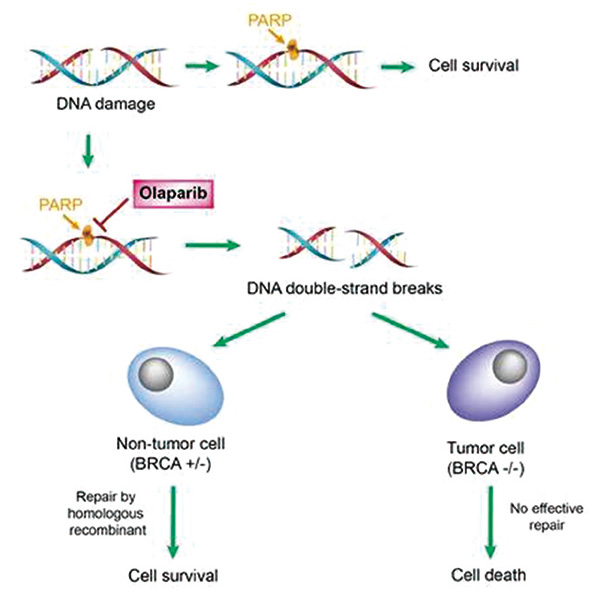
5月11日,美国食品药品监督管理局(FDA)批准了PARP抑制剂奥拉帕利(Olaparib;商品名:Lynparza)与贝伐珠单抗(bevacizumab)联合治疗作为HRD阳性人群一线维持疗法。从BRCA突变人群拓宽到更广泛的HRD阳性人群,更多患者将从精准治疗中获益。
该项新适应证获批是基于全球多中心Ⅲ期临床研究PAOLA-1/ENGOT-ov25数据,把奥拉帕利卵巢癌一线维持治疗的显著获益人群从BRCA突变拓展到同源重组缺陷(HRD)阳性,20%获益人群进一步拓展到50%。
获批适应证人群(HRD阳性)无进展生存(PFS)高达37.2个月,可见奥拉帕利与贝伐珠单抗的联合疗法,在更广泛的人群中,仍显示了卓越的疗效。
PAOLA-1研究设计中,对照组非传统研究中的安慰剂,而是美国国家综合癌症网络(NCCN)指南自2012 v3基于GOG218和ICON7研究证据进行推荐的标准方案:贝伐珠单抗联合化疗,作为初诊卵巢癌治疗方案。试验组在标准贝伐珠单抗联合化疗方案基础上,联用奥拉帕利进行维持治疗,探索为患者寻求更长期的获益,最终得到了出色的阳性结果。
今年4月以来,不同PARP抑制剂相继获得FDA一线维持治疗适应证。不同的是,一个是作为单药在ITT人群的获批;一个是联合贝伐珠单抗,在HRD阳性人群的获批。回顾两大新适应证背后的研究PAOLA-1和PRIMA。可以发现ITT人群均可从各自的PARP抑制剂方案中获益,相比对照组HR分别为0.59和0.62。其中BRCA突变(BRCAm)和HRD阳性人群的获益最显著。
针对BRCAm人群,奥拉帕利联合贝伐珠单抗 vs. 贝伐珠单抗,PFS为37.2个月 vs. 21.7个月;尼拉帕利 vs.安慰剂,PFS为22.1个月 vs. 10.9个月;HRD阳性(包含BRCAm)人群,奥拉帕利联合贝伐珠单抗 vs. 贝伐珠单抗,PFS为37.2个月 vs.17.7个月;尼拉帕利 vs.安慰剂,PFS为21.9个月 vs. 10.4个月。
对于HRD阴性人群,PRIMA研究达到统计学差异,但PFS为8.1个月 vs. 5.4个月,相比较安慰剂仅提高了2.7个月,PAOLA-1研究相比较贝伐珠单抗对照组而言,PFS为16.9个月 vs. 16个月,未达到统计学差异。
由于并非头对头研究,研究之间存在差异,不宜进行直接比较。但从整体趋势来看,PARP抑制剂用于BRCAm和HRD人群疗效已经非常明显,其中双药联合的疗效值得在临床治疗中进行参考。而对于HRD阴性人群的疗效可能还需进一步验证。可见卵巢癌精准治疗的趋势并没有改变,我们在临床实践中仍然需要根据不同的分子分型来为患者找到最合适的治疗方案。可能在PAOLA-1研究之前,只有BRCA一个生物标志物,而现在可以通过BRCA和HRD检测为患者制定更精准的诊疗方案。
HRD指同源重组缺陷,导致其发生的原因除了BRCAm以外,还有诸如HRR突变,启动子甲基化以及无法定义的其他原因。存在HRD的患者会表现为基因组的不稳定,通过基于NGS的Genomic Scar方法可判断不稳定的程度,当高于一定阈值时可判断存在HRD,即HRD阳性,HRD阳性人群占50%。
目前FDA已获批的HRD检测产品有FoundationFocus CDx BRCA LOH Assay和Myriad myChoice HRD。以Myriad为例,myChoice HRD通过分析染色体的3种异常——端粒的等位基因不平衡(TAI)、杂合性丢失(LOH)以及大片段迁移(LST),计算LOH、TAI、LST三个指标在肿瘤样本中出现的数量,≥42分定义为HRD阳性。
已知国内有几家检测公司正在开发HRD的检测方法,相信随着精准诊疗的不断推荐,国内HRD检测也会陆续上市,但算法和阈值仍然需要中国人群的数据支持,同时需要统一的技术和质控标准确保检测的可靠性。 (编译 孙宇燕)


