美国FDA批准首款靶向BCMA的CAR-T疗法
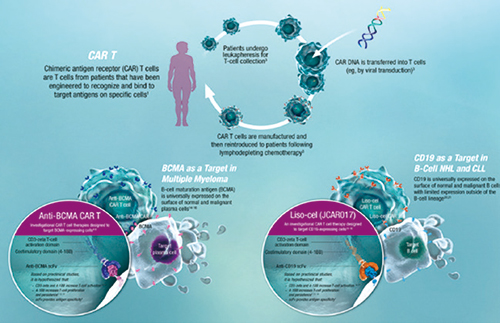
近日,美国FDA已批准靶向B细胞成熟抗原的嵌合抗原受体(CAR)-T细胞免疫疗法Idecabtagene vicleucel上市,用于治疗已经接受过四种以上前期疗法的复发/难治性多发性骨髓瘤(R/R MM)成年患者。这是获得FDA批准的首个靶向BCMA的CAR-T细胞疗法。
Idecabtagene vicleucel是靶向B细胞成熟抗原(BCMA)的基因修饰自体嵌合抗原受体(CAR)T细胞疗法,是使用患者自己的T细胞进行定制的,这些T细胞会被收集并进行基因修饰,然后再注入患者体内。

该批准基于关键性Ⅱ期临床试验KarMMa的数据,该试验对127例R/R MM患者进行了治疗,这些患者至少接受了三种前期疗法,包括免疫调节剂,蛋白酶体抑制剂和抗CD38抗体。接受Idecabtagene vicleucel(剂量为300~460×106CAR阳性T细胞)的100例患者进行了疗效评估。主要疗效指标为独立评审委员会评估的总体缓解率(ORR)、完全缓解(CR)率和缓解持续时间(DOR)。在这些患者中,有88%接受过四种或更多前期疗法,85%的患者对三种疗法产生耐药性。
在这项研究中,可评估疗效人群的总缓解率(ORR)为72%,并且28%的患者达到了严格的完全缓解(sCR)。中位缓解持续时间(DoR)为11个月。在28例获得sCR的患者中,65%的患者DoR至少12个月。
Idecabtagene vicleucel的药品使用说明中带有细胞因子释放综合征(CRS)、神经系统毒性、噬血细胞性淋巴组织细胞增生症/巨噬细胞活化综合征和长期的血细胞减少的黑框警告。Idecabtagene vicleucel最常见的副作用包括CRS、感染、疲劳、肌肉骨骼疼痛和低丙种球蛋白血症。
Idecabtagene vicleucel已通过风险评估和缓解策略的批准,该策略要求提供该疗法的医疗机构必须经过特殊认证,以识别和管理CRS和神经系统毒性。为了评估长期安全性,FDA要求生产商对使用Idecabtagene vicleucel治疗的患者进行上市后的观察研究。
(编译 韩晶)


