过度激活促癌通路可杀死肿瘤细胞?
美国博德研究所Chang等研究发现,如果过度激活WNT促癌通路,可在异种种植瘤小鼠模型和患者来源类器官中产生较强的抗肿瘤效果,抑制结直肠癌肿瘤生长。(Nat Genet. 2023; 55: 1709-1720.)
抑制致癌信号通路是精准抗肿瘤治疗的重要策略,使用小分子抑制剂或免疫抑制剂等方法抑制异常活化的促癌通路,可阻止肿瘤生长和扩散,这种策略已在多种类型肿瘤中取得突破,也存在明显局限性,比如有些靶点难以成药及治疗耐药和毒性等。
已有研究表明,如同正常细胞会因为促癌通路异常激活而产生应激反应和增殖停滞,肿瘤细胞或也无法容忍已激活的致癌信号通路进一步激活,致其存活受到影响。
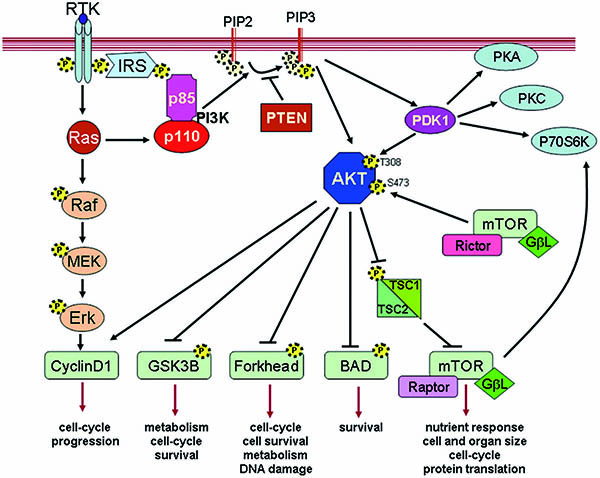
研究者通过功能增益GOF(Gain-of-Function)相关蛋白表达来过度激活MAPK、PI3K、WNT促癌通路,在约500个肿瘤细胞系中进行验证,这些细胞系都有独特的DNA条形码。
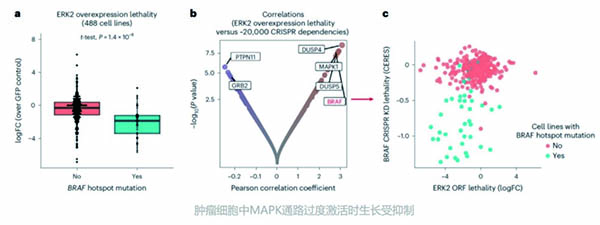
结果显示,使MAPK通路中的ERK2蛋白过表达,引起MAPK通路过度激活,会导致肿瘤细胞生长受到抑制,发生BRAF基因突变的肿瘤细胞对此更敏感,发生RAS突变的肿瘤细胞则不太敏感。
进一步研究表明,肿瘤细胞对ERK2过度激活的敏感性,与细胞内磷酸化MEK(p-MEK)基线水平存在较强的正相关,发生BRAF基因突变的肿瘤细胞中p-MEK基线水平最高。
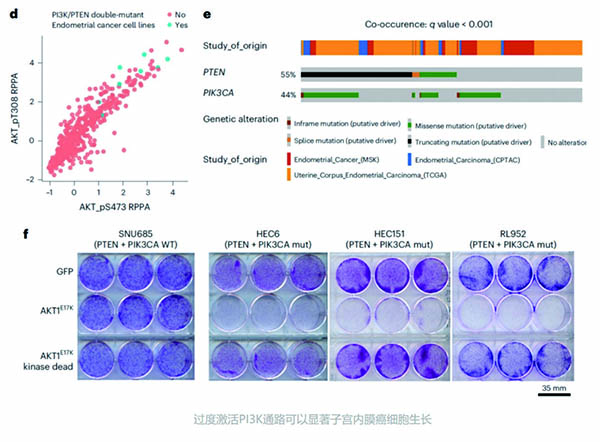
通过使AKT1E17K过表达来过度激活PI3K通路,也可诱导肿瘤细胞死亡。携带PIK3CA或PTEN基因突变的肿瘤细胞对AKT1E17K过表达更为敏感,尤其是同时携带这两种基因突变的肿瘤细胞。
三组子宫内膜癌患者的大样本队列分析显示,有30%的患者同时有PIK3CA和PTEN基因突变。在体外实验中,诱导AKT1E17K过表达可明显抑制PIK3CA/PTEN基因双突变的子宫内膜癌细胞系(HEC6、RL952、HEC151)生长,而不会导致PIK3CA/PTEN基因皆为野生型的子宫内膜癌细胞系(SNU685)生长受损,这为子宫内膜癌的精准治疗提供了一个策略。
通过使β-连环蛋白过表达来过度激活WNT通路,对肿瘤细胞生长有同样的抑制效果,携带APC突变的肿瘤细胞系敏感性最强。
鉴于80%的结直肠癌患者携带APC基因突变。研究者利用结直肠癌小鼠模型和结直肠癌患者来源的类器官进行探索,发现过表达β-连环蛋白可以显著减缓肿瘤生长。
正常情况下,APC基因编码的蛋白、CSNK1A1基因编码的蛋白等,会与β-连环蛋白结合形成复合物,促使β-连环蛋白被降解;当APC或CSNK1A1基因功能缺陷时,细胞内β-连环蛋白无法被降解并积累,WNT促癌通路激活。因此,针对携带APC基因突变的结直肠癌的治疗策略,主要集中在抑制β-连环蛋白上。
研究者观察到,除了过表达β-连环蛋白,将携带APC突变的结直肠癌细胞中的APC基因敲低表达,也会导致小鼠或类器官的肿瘤细胞死亡。体外实验中敲除结直肠癌细胞系的CSNK1A1基因,同样能增加对β-连环蛋白过表达的敏感性。提示通过干预破坏β-连环蛋白降解复合物,从而引发WNT信号通路进一步激活,可能对于携带APC突变的结直肠癌患者来说是不错的策略。
相较于许多精准肿瘤治疗通过抑制癌症信号通路发挥作用,该研究揭示,通过强制过度激活促癌通路,实现选择性抑制携带不同突变的肿瘤细胞生长,为精准抗肿瘤治疗提供了新的思路,未来进一步研究或需探讨这种过度激活对正常组织稳态的影响。(编译 王宇航)


