2018年AACR会议的主要临床研究总结

南京医院肿瘤科 陈锦飞
2018 AACR年会于近日在美国芝加哥隆重举行。AACR是世界上创立最早、规模最大的专注于癌症研究的科学组织,对于推动全球肿瘤事业的发展和进步具有重大意义和影响力。在本次AACR年会上公布了多项肿瘤免疫治疗的重磅研究,以下带来现场公布的部分精彩内容。在最后的会议总结阶段,2017~2018年AACR主席Michael A. Caligiuri教授对本次会议上的主要临床研究进行了总结,现总结如下。
KEYNOTE-189研究:转移性非鳞NSCLC
派姆单抗联合培美曲塞+铂类一线治疗研究
KEYNOTE-189研究是免疫检查点抑制剂联合化疗用于晚期NSCLC一线治疗的第一个Ⅲ期研究。该研究招募了616例未接受过转移性疾病治疗的无EGFR或ALK突变的Ⅳ期非鳞NSCLC患者。患者以2︰1的比例随机接受派姆单抗和化疗联合治疗(410例)或单独化疗(206例)。
所有患者接受培美曲塞500 mg/m2和卡铂(AUC=5)或顺铂75 mg/m2治疗,每3周一次,共4个周期,然后培美曲塞每3周维持治疗。免疫治疗组接受派姆单抗 200 mg,共35个周期。
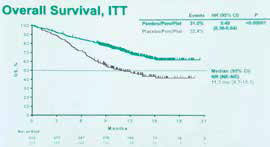
在中位随访10.5个月后,派姆单抗组和单纯化疗组的1年生存率分别为69.2%和49.4%(HR=0.49,95%CI 0.38~0.64,P<0.001);两组中位PFS分别为8.8个月和4.9个月(HR=0.52,95%CI 0.43~0.64,P<0.001);OS分别为未达到和11.3个月。
此外,无论PD-L1表达水平如何,所有亚组患者均可观察到OS和PFS获益;然而,对于PD-L1水平较高的患者,OS和PFS的获益在数值上更高。3~4级不良反应的发生率分别67.2%和65.8%。该研究将正式奠定派姆单抗联合培美曲塞+铂类方案用于EGFR和ALK野生型晚期非鳞NSCLC一线治疗的地位。
CheckMate 227研究:晚期NSCLC
纳武单抗联合伊匹单抗对比化疗一线治疗研究
在CheckMate 026研究中,纳武单抗单药对比含铂双药化疗用于晚期NSCLC一线治疗并未获得成功。CheckMate 227研究根据CheckMate 026研究中肿瘤突变负荷(TMB)的结果修改了研究设计,在本次AACR大会上报道了部分数据。
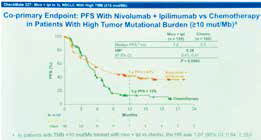
此次公布的结果为对比含铂双药化疗与纳武单抗+伊匹单抗在一线治疗晚期或复发性NSCLC患者中的疗效和安全性。在入组的299例TMB高表达(TMB≥10个突变/mb)的患者中,139例接受纳武单抗+伊匹单抗联合治疗,160例接受化疗。
免疫联合治疗组及化疗组的1年PFS率分别为43%和13%。经过至少11.5个月的随访,疾病进展风险降低42%(HR=0.58,95%CI 0.41~0.81,P=0.0002)。免疫联合治疗组和化疗组的客观缓解率(ORR)分别为45.3%和26.9%;总生存期数据尚未成熟,目前1年OS率分别为67%和58%(HR=0.79,95%CI 0.56~1.10)。
此外,亚组分析发现,免疫联合治疗对PD-L1≥1%和<1%患者的PFS均能显著提高(PD-L1≥1%:HR=0.62,95%CI 0.44~0.88;PD-L1<1%:HR=0.48,95%CI 0.27~0.85)。在鳞癌(HR=0.63,95%CI 0.39~1.04)和非鳞癌组织学类型(HR=0.55,95%CI 0.38~0.80)中均观察到联合治疗的获益。
安全性方面,与前期报道一致,免疫联合治疗组与化疗组相比,治疗相关3~4级毒副反应发生率分别为31%和36%。免疫联合治疗组为皮肤反应(34%),内分泌(23%),胃肠道(18%),肝脏(15%),肺(8%),过敏(4%)和肾脏(4%)事件。联合治疗组和化疗组的治疗相关死亡发生率均为1%。
总之,对于高TMB的晚期NSCLC患者,纳武单抗+伊匹单抗联合治疗明显优于化疗,延长患者PFS,降低其疾病进展风险;也奠定了纳武单抗联合伊匹单抗治疗高TMB的NSCLC患者一线治疗的地位。同时也表明TMB可作为初治晚期NSCLC患者应用双免疫联合治疗的生物标志物。
新药研究
RET抑制剂BLU-667:Ⅰ期临床数据显示:针对RET突变或者融合的肿瘤患者,BLU-667的有效率高达46%,疾病控制率高达96%。
MUC单抗DMUC4064A:一项针对铂类耐药的卵巢癌使用DMUC4064A的Ⅰ期临床试验结果显示,客观反应率达45%,中位PFS达到5.8个月。
深度解读
随着肿瘤免疫治疗时代的到来,临床工作者们还需面临诸多挑战。
1.生物标志物:到底哪一类患者可以从免疫检查点抑制剂中获益呢?PD-L1表达是判断免疫检查点抑制剂疗效的潜在指标;但针对不同病理类型的患者,PD-L1表达的预后价值,以及PD-L1表达的临界值(cut-off)也有待于进一步研究。除了PD-L1表达之外,还有许多正在研究中的预后标志物,如肿瘤突变负荷(TMB),微卫星不稳定等,期待更多的更有临床价值的肿瘤免疫治疗的生物标志物确立。
2.免疫治疗的耐药机制及合理的联合治疗研究:尽管免疫治疗已经取得极大的临床疗效,但多数患者耐药不可避免。而耐药导致的缓解率不高进而引发肿瘤的复发再进展。深入了解其中的耐药机制能够为克服肿瘤免疫耐药提供理论基础。应对肿瘤免疫耐药的一个有效方法就是联合用药。抗PD-1与抗CTLA-4联合用药治疗转移性黑色素瘤显示出更高的疗效。除了免疫检查点抑制剂之间联用,免疫检查点抑制剂与共刺激因子激动剂、靶向药、放疗化疗以及表观遗传修饰因子的联用是未来的研究方向。
3.新的治疗终点的寻找:有研究表明,目前半数肿瘤免疫治疗药物的临床试验得出的无进展生存期和总生存期结果并不一致。这让我们思考是否有其他新的治疗终点能够更准确地反映免疫治疗的临床获益?


