研究发现新型肠菌直接促进肝癌发生
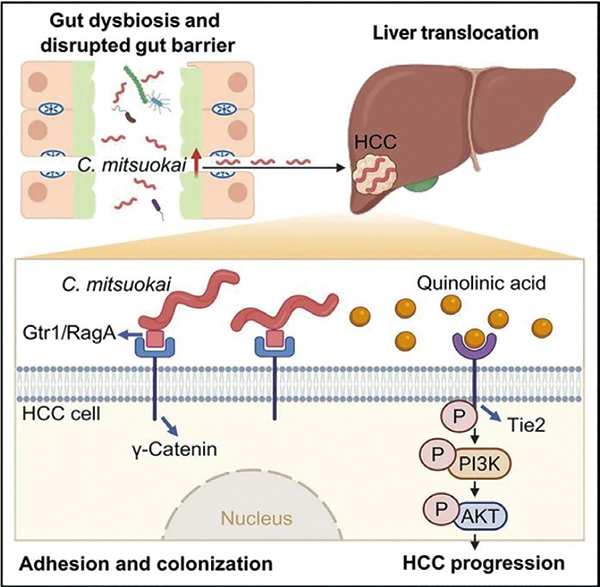
香港中文大学于君和中山大学附属第一医院匡铭等发现肝癌患者的粪便和肿瘤中富集链型杆菌属(Catenibacterium)细菌,并发现这个属的唯一潜在致病菌Catenibacterium mitsuokai,在体内和体外的多种肝癌模型中均表现出促肿瘤作用。该肠菌可通过肠肝轴途径直接促进肝癌发生。该细菌不仅能突破肠道屏障定植于肝脏,还能通过分泌特定代谢物激活致癌信号通路,为肝癌防治开辟了全新思路。(Cell. Metab. 2025年10月7日在线版)
C. mitsuokai会引起肠道屏障功能障碍并易位到肝脏,通过与肝癌细胞上的特定蛋白相互作用,C. mitsuokai可在肝脏中定植存活;肝脏驻留的C. mitsuokai进一步合成代谢物喹啉酸,激活TIE2/PI3K/AKT信号通路,从而促进肝癌的发展。
研究者分析了52例肝癌患者的肿瘤组织和粪便样本,及50例健康捐赠者的肝组织和粪便样本。检测结果显示,肝癌患者的肿瘤组织和粪便样本中富集链型杆菌属细菌,且粪便和组织样本的链型杆菌属细菌阳性率更高。考虑到当前只在链型杆菌属细菌中发现一种潜在致病菌——革兰氏阳性厌氧菌C. mitsuokai,研究者又分析了另一个独立肝癌队列的数据,发现33.3%的粪便样本和13.2%的肿瘤组织中存在C. mitsuokai。
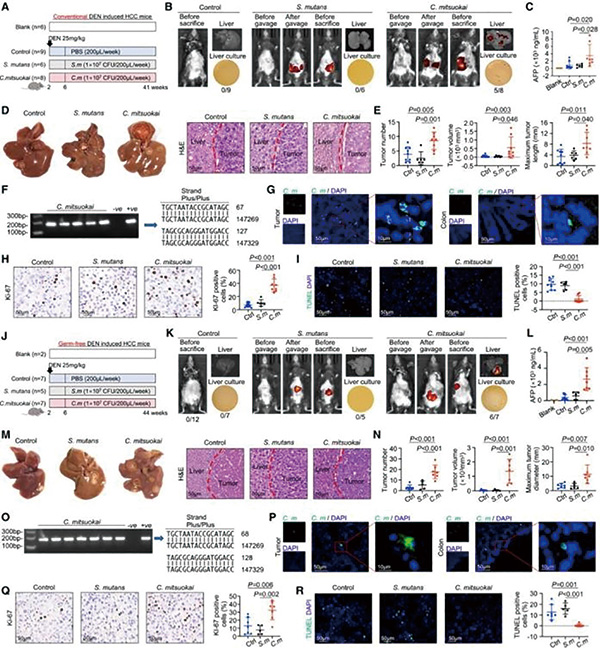
研究发现C. mitsuokai在肝癌患者肠道和肿瘤组织中显著富集。5例患者体内同时检测到该细菌存在于粪便和肿瘤组织中,提示可能存在肠道-肝脏的直接细菌转移路径,这是首次在肝癌组织中发现特定致病菌定植的证据。
为了探讨C. mitsuokai在肝癌发生发展中的作用,研究者构建了不同的原位肝癌小鼠模型,还构建了代谢功能障碍相关脂肪性肝炎(MASH)相关的肝癌模型,发现C. mitsuokai均可促进肝癌的进展,无论是原位移植,还是高脂饮食诱导的MASH相关肝癌模型。随后的研究发现,经口灌胃的C. mitsuokai,可破坏空回肠和结肠上皮的紧密连接和黏附连接,损害肠道屏障功能,以活菌的形式转移至肝脏。电子显微镜观察到该细菌会导致肠道紧密连接蛋白表达下降30%~50%,黏液层厚度减少近一半。细菌表面蛋白Gtr1/RagA如同胶水,能与肝癌细胞表面的γ-连环蛋白(结合亲和力达32.4 nM)特异性结合。敲除该受体后,细菌在肝癌细胞的黏附能力下降70%以上。
研究发现,细菌分泌的喹啉酸(quinolinic acid, QA)是关键致癌因子。质谱分析显示,肝癌组织中QA浓度比正常肝组织高2~3倍。这种小分子代谢物能特异性结合肝癌细胞上的TIE2受体,激活PI3K/AKT这条促癌路径,进而加速肝癌的发展。若使用TIE2抑制剂(如已进入临床试验的linsitinib),可完全消除C. mitsuokai的促癌作用,提示针对该通路的靶向治疗可能成为肝癌联合治疗的新策略。
该研究证实C. mitsuokai是一种促肝癌细菌,并揭示了背后的分子机制,证实了肠肝轴在肝癌发生发展中的作用,提示靶向TIE2/PI3K/AKT通路对肝癌的治疗作用值得探讨。
(编译 张莉莉 杨柳)