全球首款CAR-T疗法新适应证获批
日前,美国FDA批准诺华公司全球首款CAR-T疗法Tisagenlecleucel(Kymriah)新适应证,用于治疗复发或难治性(r/r)弥漫性大B细胞淋巴瘤的(DLBCL)成人患者。这是该疗法继去年8月获批首个适应证难治或复发B细胞前体急性淋巴性白血病(ALL)之后的第二个获批适应证(自FDA)。
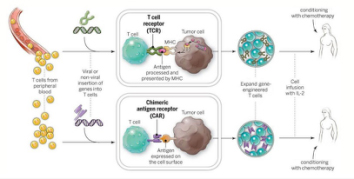
目前获批的新使用证是基于JULIET研究数据,该研究于去年12月美国血液病学会(ASH)年会上进行了报告,是第一项全球多中心r/r DLBCL成人患者临床试验,也是CAR-T疗法治疗DLBCL最大样本临床研究。
研究结果显示,81例患者在3个月或更长时间随访中,客观缓解率达53%,完全缓解(CR)率为40%,部分缓解率14%。接受Tisagenlecleucel输注6个月后,客观缓解率为37%,CR率为30%,中位缓解持续时间未达到。
不同亚组的缓解率也是一致的,包括接受过自体造血干细胞移植的患者和DLBCL亚型(双击淋巴瘤)患者,这些预后不良患者接受CAR-T疗法后均未接受干细胞移植。
该研究中,首次缓解后6个月内无复发率为74%,中位持续缓解时间未达到,中位总生存未达到,从输注到数据截止中位时间为5.6个月。
接受治疗的患者中,58%的患者发生细胞因子释放综合征(CRS),其中23%的患者出现3~4级CRS,21%的患者发生任何级别神经系统不良事件,12%的患者发生3~4级神经系统不良事件,未出现因CRS或神经系统不良事件死亡病例。
研究者认为,这些DLBCL患者已经过多轮化疗,许多患者干细胞移植失败,治疗选择不多,预后很差。接受该CAR-T疗法可显著增加这些患者获得和维持持续缓解的机会,无需干细胞移植,证实该疗法在这类血液系统恶性肿瘤治疗方面的益处。
(编译 王安祺)


