欧洲肿瘤内科学会(ESMO)2018年会

编者按
一年一度的欧洲肿瘤内科学会(ESMO)年会在德国慕尼黑举行,作为欧洲最大的临床肿瘤学术会议,ESMO每年吸引2万多肿瘤领域同道参会,很多重要研究首次在会上公布,值得关注。
SOLO-1研究
Olaparib一线维持治疗BRCA突变卵巢癌研究
会上报告了靶向抗癌药Olaparib(奥拉帕利,利普卓)作为维持疗法一线治疗BRCA突变晚期卵巢癌的Ⅲ期临床研究SOLO-1数据。SOLO-1研究结果显示,Olaparib是目前唯一显示显著降低新诊断晚期BRCA突变卵巢癌患者铂类化疗后疾病进展风险的PARP抑制剂。
SOLO-1研究是一项随机、双盲、安慰剂对照、多中心研究,旨在评估Olaparib片剂(300mg,每日2次)作为一线维持单药疗法相对于安慰剂用于治疗接受含铂化疗后的新诊晚期BRCA突变卵巢癌患者的疗效和安全性。
该研究共入组391例BRCA突变晚期卵巢癌患者,这些患者携带一种有害或疑似有害BRCA1或BRCA2突变,并且在接受含铂化疗后处于临床完全缓解或部分缓解。患者以2:1的比例被随机分配接受Olaparib(300mg片剂,每日2次)或安慰剂(片剂,每日2次)治疗长达2年时间或直至疾病进展(由研究人员判断)。主要终点是无进展生存期(PFS),关键次要终点包括第二次疾病进展或死亡时间、第一次后续治疗时间、总生存期(OS)。
结果显示,与安慰剂组相比,Olaparib组无进展生存有统计学意义和临床意义上的改善,疾病进展或死亡风险降低70%(HR=0.30,95%CI 0.23~0.41,P<0.001)。随访41个月,Olaparib组中位PFS尚未达到,安慰剂组为13.8个月。接受Olaparib治疗的患者中,有60%在治疗36个月内疾病无进展,安慰剂组为27%。
该研究中观察到的安全性与先前研究中一致,最常见的不良反应(AE)为恶心(77%)、疲劳/乏力(63%)、呕吐(40%)、贫血(39%)和腹泻(34%)。最常见的3级不良反应为贫血(22%)和中性粒细胞减少(9%)。Olaparib组有72%的患者仍保持推荐的起始剂量。此外,Olaparib组有88%的患者继续治疗,无不良反应相关治疗中断。
阿斯利康相关负责人表示,当前晚期卵巢癌治疗领域存在着显著的未满足需求,有高达70%的患者在接受初始治疗后疾病会在3年内复发。来自SOLO-1研究的数据显示,Olaparib单药维持治疗新诊晚期BRCA突变卵巢癌患者中有高达60%的患者疾病在3年内仍无进展,彰显了Olaparib作为一线维持疗法的潜力。
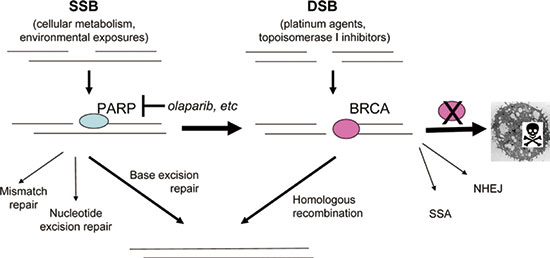
Olaparib 已于2018年8月在中国获批,标志着卵巢癌进入PARP抑制剂治疗时代。Olaparib是一种首创口服PARP抑制剂,利用DNA修复缺陷优先杀死癌细胞,这种作用模式赋予了Olaparib治疗DNA修复缺陷的多种类型肿瘤的潜力。PARP与多种肿瘤类型相关,尤其是乳腺癌和卵巢癌。
Olaparib是全球上市的首个PARP抑制剂,于2014年12月首次获美国FDA批准上市。截至目前,该药已获全球60多个国家批准用于铂敏感复发性卵巢癌(不论BRCA状态如何);此外,该药也已获美国、加拿大、日本、澳大利亚批准,用于存在种系BRCA突变的HER2阴性转移性乳腺癌。目前,阿斯利康正开展多项临床研究,探讨Olaparib用于多种类型肿瘤包括乳腺癌、前列腺癌、胰腺癌的潜力。
Olaparib(利普卓)于今年8月23日获得中国国家药品监督管理局(CNDA)批准,用于铂敏感复发性卵巢癌的维持治疗。利普卓成为中国首个获批治疗卵巢癌的靶向药物,标志着中国卵巢癌治疗进入PARP抑制剂时代。
(编译 唐宁)
IMpower130研究
Atezolizumab联合化疗一线治疗非鳞肺癌显著延长PFS
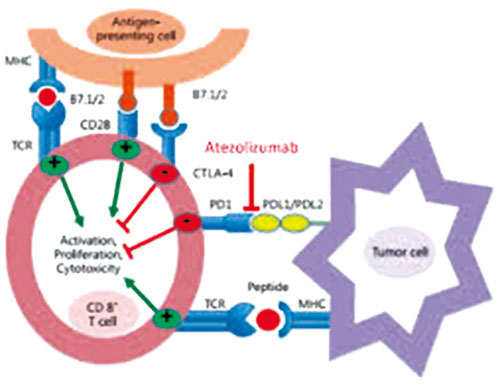
会上报告的PD-L1肿瘤免疫疗法Atezolizumab(Tecentriq)一线治疗非鳞肺癌的Ⅲ期临床研究IMpower130的积极数据。
IMpower130是一项多中心、开放标签、Ⅲ期随机研究,入组既往未接受化疗(化疗初治)的Ⅳ期非鳞状非小细胞肺癌(NSCLC)患者,评估Atezolizumab联合化疗(卡铂+白蛋白结合型紫杉醇)相对于单纯化疗的疗效和安全性。
研究共入组723例患者,以2:1的比例随机进Atezolizumab组和单纯化疗组。研究的共同主要终点为研究者根据实体瘤疗效评价标准RECIST v1.1评估的意向性治疗野生型患者(ITT-WT)的无进展生存期(PFS)和总生存期(OS)。
结果显示,该研究达到OS和PFS共同主要终点:在ITT-WT患者亚群中,与化疗相比,Atezolizumab联合化疗使患者生存时间显著延长近5个月(中位OS:18.6个月 vs. 13.9个月,HR=0.79,95%CI 0.64~0.98 ,P=0.033),使患者疾病进展或死亡风险显著降低36%(中位PFS:7.7个月 vs. 5.5个月,HR=0.64,95%CI 0.54~0.77,P<0.0001)。
安全性方面,Atezolizumab+化疗组合的安全性与单一药物已知的安全性一致,未发现新的安全信号。接受Atezolizumab组有73.2%的患者报告3~4级治疗相关不良反应,而单纯化疗组有60.3%。
非鳞状NSCLC是最常见的肺癌类型,该研究提示,Atezolizumab与化疗联合用药一线治疗为该类患者带来显著生存受益。
截至目前,Atezolizumab已在全球70多个国家获批,用于经治转移性NSCLC患者及初治或经治转移性尿路上皮癌(mUC)患者的治疗。肺癌方面,罗氏正在开展8项Ⅲ期研究,评估Atezolizumab作为单药以及与其他药物联合用药的治疗潜力。
(编译 王靓)
免疫疗法和化疗显著延长三阴性乳腺癌患者生存
会上报告的研究首次证实联合使用免疫疗法和化学疗法能对三阴性乳腺癌患者的免疫系统加以调整,使其能攻击这种癌症,延长患者生存长达10个月,降低40%的疾病进展和死亡风险,为三阴性乳腺癌患者带来了希望。研究同时在《新英格兰医学杂志》上发表。
该研究探讨标准每周白蛋白结合紫杉醇(Nab-Paclitaxel)联合每两周服用一次的免疫治疗药物Atezolizumab(阿特朱单抗,Tecentriq)治疗三阴性乳腺癌的疗效。这种组合疗法的作用机制是白蛋白结合紫杉醇让癌症表面变得“粗糙化(roughening up)”,这使得阿特朱单抗能让免疫系统更好地识别癌症为外来物并进行抗击。
三阴性乳腺癌通常影响年轻女性,标准治疗方法是化疗,但大多数患者很快产生耐药。若疾病扩散到身体其他部位,生存期通常只有12~15个月。该研究是第一项显示可延长三阴性乳腺癌患者生存的免疫疗法研究。
研究者指出,该研究使我们的治疗往前进了一大步,改观了三阴性乳腺癌的治疗,第一次证实免疫疗法是可以为这类患者带来显著生存获益的。该研究结果已提交相关机构进行审批,相信这一组合治疗方案不久的将来有望面市,造福亟需治疗新选择的三阴性乳腺癌患者。
(编译 唐宁)
PALOMA-3研究
Palbociclib改善HR+/HER2-晚期乳腺癌患者总生存
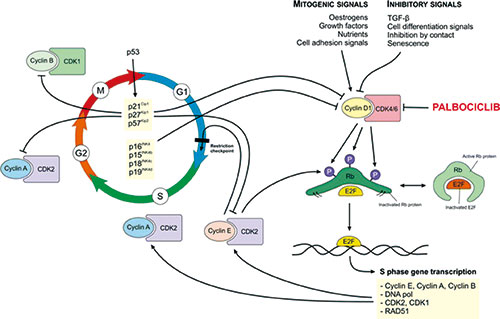
会上报告的PALOMA-3研究的总生存数据显示,CDK4/6抑制剂Palbociclib(Ibrance)可改善既往内分泌治疗复发或进展的HR+/HER2-晚期乳腺癌患者的总生存,Palbociclib+氟维司群组总生存延长近7个月,这种改善有临床意义。(摘要号LBA2_PR)
大多数HR+乳腺癌患者随着时间的推移会对内分泌治疗产生耐药性,已明确抑制CDK4/6通路可克服或延迟HR+/HER2-晚期乳腺癌对内分泌治疗耐药。此前发表的PALOMA-3研究数据显示,Palbociclib联合氟维司群显著改善既往内分泌治疗进展的HR+/HER2-转移性乳腺癌患者无进展生存。
目前报告的是总生存数据,521例HR+/HER2-晚期乳腺癌患者中位随访44.8个月。既往内分泌治疗后复发或进展患者被随机分配接受Palbociclib(125 mg/d,口服,给3W/停1W)+氟维司群(500 mg /标准治疗)组或安慰剂+氟维司群组。521例患者中约60%(130例)死亡时,进行总生存分析。
结果显示,与安慰剂+氟维司群组(中位OS 28.0个月)相比,Palbociclib+氟维司群组的中位OS延长6.9个月(34.9个月,95%CI 28.8~40.0个月,P=0.043)。既往内分泌治疗敏感的亚组人群,中位OS延长10.0个月;无内脏疾病亚组的中位OS显著延长11.5个月。随着随访时间的延长,未发现新的安全事件。
研究者指出,这是证明OS绝对延长与整体人群中PFS绝对获益相似的首次报道。对于内分泌治疗敏感患者,生存延长的程度较大。探索性分析显示,Palbociclib+氟维司群组中位至接受化疗时间为17.6个月,对照组为8.8个月。
辉瑞公司相关负责人表示,推迟化疗必要性是这类患者治疗的中心目标,PALOMA-3研究新数据表明,将Palbociclib添加至氟维司群带来的总生存和至化疗时间改善,支持Palbociclib联合内分泌治疗作为HR+/HER2-转移性乳腺癌标准治疗。
Palbociclib是首创口服靶向CDK4/6抑制剂,可选择性抑制细胞周期蛋白依赖性激酶4/6,恢复细胞周期,阻断肿瘤细胞增殖。CDK4/6是细胞周期关键调节因子,在ER阳性乳腺癌中过度活跃,CDK4/6是ER信号通路关键下游因子。临床前研究表明,CDK4/6和ER信号双抑制有协同作用,可抑制G1期ER阳性乳腺癌的生长。
Palbociclib是全球首个上市的CDK4/6抑制剂,已在包括中国在内的87个国家/地区获批上市。2017年该药全球销售额达31.26亿美元,有报告预测到2024年,该药全球销售额将达到82.84亿美元,成为全球最畅销的乳腺癌靶向药物。
有评论专家表示,CDK4/6抑制剂的临床获益无可争辩,但PFS获益能否转化为OS获益是热门话题。该研究首次显示,在HR+/HER2-转移性乳腺癌患者中,应用CDK4/6抑制剂可延长OS。该研究的OS数据解读应谨慎,尽管结果强烈提示PFS获益可能转化为OS获益,但仍需CDK4/6抑制剂的其他相关试验证实该研究中观察到的OS获益。
有评论者指出,CDK4/6抑制剂对转移性乳腺癌DFS和OS的改善,使我们对这类药物在早期乳腺癌中的潜力感到期待,目标是提高治愈率。目前,两项关于Palbociclib用于早期乳腺癌辅助治疗的随机试验PENELOPE-B和PALLAS研究正在进行中。
(编译 邱鹏飞 唐宁 审校 王永胜)
SOLAR-1研究
Alpelisib治疗PI3KCA突变HR+HER2-晚期乳腺癌
会上报告了乳腺癌全球性Ⅲ期临床研究SOLAR-1研究最新结果,治疗激素受体(HR)阳性HER2阴性晚期乳癌患者,特异性PI3Kα抑制剂Alpelisib可改善无进展生存。(摘要号LBA3_PR)
研究者指出,Alpelisib是首个在乳腺癌患者的基因组亚群中显示出疗效的药物,我们已经有了针对HER2蛋白的抗HER2靶向药物。但不同于黑色素瘤或肺癌,迄今为止,肿瘤基因组学的应用并未真正进入乳腺癌的实际治疗。
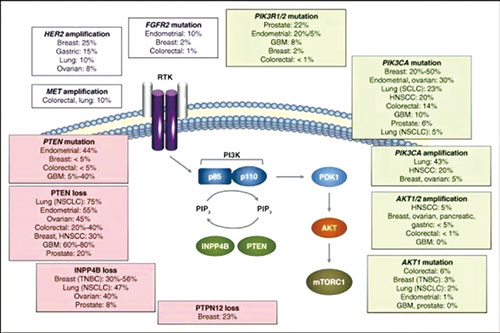
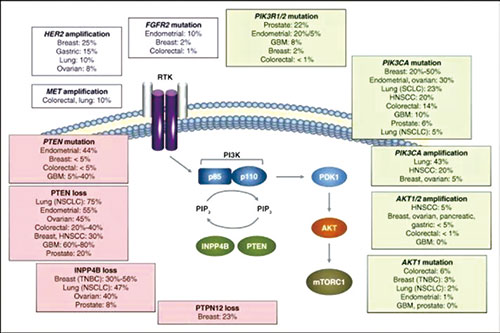
约40%的HR阳性乳腺癌患者存在PI3KCA突变,激活PI3K通路,可导致癌症进展和对内分泌治疗耐药。Alpelisib(BYL719)是一种具有α亚型特异性的口服PI3K抑制剂。
PI3K在乳腺癌中发生突变的是α亚型。之前的PI3K抑制剂针对所有四种亚型,因此引起多种毒性反应。关于Alpelisib的Ⅰ期临床试验初步结果显示,疗效良好,安全性可控。
研究详情
SOLAR-1试验随机选择572例HR阳性、HER2阴性绝经后女性或男性晚期乳腺癌患者,341例肿瘤组织检测出PI3KCA突变,患者随机分组分别接受口服Alpelisib (300 mg/d)或安慰剂加肌肉注射氟维司群(500 mg,每28天,第1周期的第1、15天)治疗。入组标准为:ECOG PS评分≤1分,既往接受过一线或多线内分泌治疗,且未接受过解救化疗。既往未接受过氟维司群(Faslodex)或任何PI3K、Akt或mTOR抑制剂治疗,未接受其他抗癌治疗。
结果显示,Alpelisib组PI3KCA突变患者的PFS几乎是安慰剂组患者的两倍。Alpelisib组的中位PFS为11.0个月,安慰剂组为5.7个月(HR=0.65,95%CI 0.50~1.25,P=0.00065),中位随访时间为20.0个月。
有PI3KCA突变的晚期乳腺癌患者中(262例),超过三分之一(36%)对Alpelisib联合氟维司群治疗有反应,而安慰剂加氟维司群组的总缓解率(ORR)为16%(P=0.0002)。在没有PI3KCA突变的患者中,局部评估的无进展生存的次要终点没有达到预设值(HR=0.85,95%CI 0.58~1.25;中位PFS:7.4 个月 vs. 5.6 个月)。
研究者表示,对于PI3KCA突变、HR阳性HER2阴性晚期乳腺癌患者,Alpelisib使延长预期寿命成为可能。不过目前随访时间尚短,尚不能确定OS是否有获益。但Alpelisib带来的PFS改善,将有望转化为OS改善。
Alpelisib最常见的不良反应是高血糖(可用二甲双胍治疗)、恶心、食欲减退和皮疹。未发生危及生命的或会影响生活质量的严重毒性,提示Alpelisib或宜优先于化疗给予患者。
评论和研究者说
有评论专家指出,针对这类患者,这是目前唯一显示PI3K抑制剂结合内分泌治疗有获益的临床研究。
下一步的关键问题是研究何时、以及如何将这种药物纳入当前治疗。是与内分泌治疗和CDK4/6抑制剂治疗联合使用,还是内分泌治疗和CDK4/6抑制剂治疗进展后序贯使用。该研究的一个局限性是,只有少数患者接受了CDK4/6抑制剂的提前治疗。
研究者认为,该研究打开了乳腺癌临床基因组学研究的大门,因为它首次表明,基于患者肿瘤基因组谱的治疗可改善预后。预测该研究将对临床实践产生重大影响,必须对乳腺癌患者进行基因检测。评论专家认为,若PI3K抑制剂成为晚期乳腺癌患者的治疗选择,使用血浆样本(液体活检)评估PI3KCA突变将成为标准策略。
(编译 张朝蓬 审校 王永胜)
PARP抑制剂治疗BRCA突变型前列腺癌
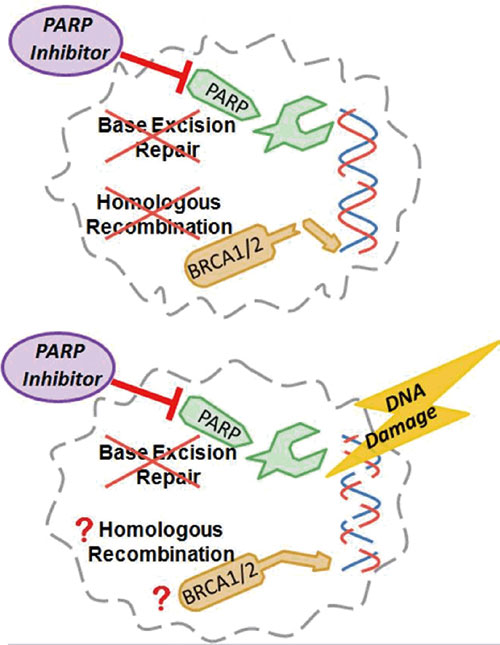
会上报告了靶向抗癌药Rucaparib(Rubraca)Ⅱ期临床研究TRITON2的初步数据,该研究显示,PARP抑制剂Rucaparib可为BRCA1/2突变的转移性去势抵抗性前列腺癌患者带来获益。
该研究是一项国际多中心开放标签Ⅱ期研究,在BRCA基因改变(包括生殖系或体细胞)的转移性去势抵抗性前列腺癌患者中开展,该研究也招募其他同源重组(HR)修复基因(包括ATM基因)存在有害基因改变的患者。
会上公布的初步数据显示,在25例携带一种BRCA1/2基因改变的RECIST/PCWG3可评估患者中,Rucaparib治疗的客观缓解率(ORR)为44%(11/25例),中位缓解持续时间未达到。在45例携带一种BRCA1/2基因改变的PSA反应可评估患者中,Rucaparib治疗的PSA反应率为51.1%(23/45例)。
今年10月,基于TRITON2研究结果,美国FDA已授予Rucaparib单药治疗BRCA1/2突变mCRPC患者的突破性药物资格(BTD),治疗既往已接受至少一种雄激素受体(AR)靶向疗法和紫杉烷化疗的BRCA1/2突变mCRPC患者。
研究者指出,Rucaparib在已获批的晚期卵巢癌适应证中显示出较强的抗肿瘤活性。TRITON2研究数据表明,Rucaparib或可为BRAC1/2突变mCRPC患者新的治疗选择,有望为这类鲜有治疗选择的患者带来临床获益。
Rucaparib是一种口服小分子多聚ADP核糖聚合酶(PARP)抑制剂,可靶向抑制PARP1、PARP2、PARP3。Rucaparib可利用DNA修复途径的缺陷,优先杀死癌细胞,这种作用模式赋予了该药治疗存在DNA修复缺陷的多种类型肿瘤中的治疗潜力。目前,Clovis正开发Rucaparib单药疗法及联合其他抗肿瘤药物,用于多种类型肿瘤包括卵巢癌、转移性去势抵抗性前列腺癌、膀胱癌的治疗。
在美国,Rucaparib于2016年12月首次获FDA加速批准,用于既往接受过两次及以上化疗、携带有害BRCA突变(生殖系和/或体细胞)的卵巢上皮癌、输卵管癌或原发性腹膜癌成人患者的治疗。今年4月,FDA进一步批准Rucaparib用于接受含铂化疗后实现完全缓解或部分缓解的复发性卵巢上皮癌、输卵管癌或原发性腹膜癌成人的维持治疗,同时将Rucaparib的首个适应证由加速批准转为正式批准。
(编译 王钰)
BRAF V600突变Ⅲ期黑色素瘤
Dabrafenib+Trametinib组合疗法显著降低复发风险
会上报告了靶向组合疗法Dabrafenib+Trametinib(Tafinlar+Mekinist)治疗黑色素瘤Ⅲ期临床研究COMBI-AD的更新数据。该组合疗法已于今年4月底获FDA批准,成为BRAF V600E/K突变阳性黑色素瘤术后治疗有显著临床受益的首个口服靶向组合疗法。
COMBI-AD研究是一项随机、双盲、安慰剂对照研究,共入组870例已完成手术完全切除且未接受抗癌治疗的Ⅲ期BRAF V600E/K突变阳性黑色素瘤患者,评估了Dabrafenib(150 mg bid)+ Trametinib(2 mg qd)组合疗法(438例)或相应的安慰剂(432例)用于术后辅助治疗的疗效和安全性。
此前公布的中位随访2.8年的数据显示,该研究达到无复发生存(RFS)的主要终点。与安慰剂组相比,联合治疗组疾病复发或死亡风险降低53%(中位RFS:未达到 vs. 16.6个月,HR=0.47,95%CI 0.39-0.58,P<0.001);安慰剂组3年无复发生存率为39%,联合治疗组为58%。
联合治疗在所有患者亚组均表现出了RFS治疗受益,在关键次要终点OS方面也有改善(HR=0.57,95%CI 0.42-0.79,P=0.0006,未达预设有统计学意义的阈值),在其他次要终点也表现出临床意义的改善,包括无远处转移生存率(DMFS:HR=0.51,95%CI 0.40-0.65)和无复发生存率(FFR:HR=0.47,95%CI 0.39-0.57)。
此次会上报告的数据显示,联合治疗组中位随访时间44个月,安慰剂组42个月;联合治疗组3年、4年无复发生存率分别为59%和54%,安慰剂组分别为40%和38%(HR=0.49,95%CI 0.40-0.59)。联合治疗在所有患者亚组均显示无复发生存受益,包括ⅢA、ⅢB、ⅢC期患者亚组。
联合治疗组预计1年、2年、3年、4年RFS均高于安慰剂组(1年:88% vs. 56%;2年:67% vs. 44%;3年:59% vs. 40%;4年:54% vs. 38%)。联合治疗组次要终点无远处转移生存率也有改善(HR=0.53,95%CI 0.42-0.67)。
据估计,全球每年确诊约20万例黑色素瘤新发病例,其中约半数携带BRAF突变。Ⅲ期黑色素瘤在手术切除后,可能仍有黑色素瘤细胞在体内残留,术后有很高的复发风险。对高危黑色素瘤患者给予辅助治疗,可帮助降低疾病复发风险。
Dabrafenib和Trametinib分别靶向RAS/RAF/MEK/ERK信号级联通路中的丝氨酸/苏氨酸激酶家族成员BRAF和MEK1/2,该信号通路的异常激活被认为在NSCLC、黑色素瘤及其他类型癌症的发病中发挥重要作用。
在美国,该组合已获批用于BRAF V600E/K突变阳性黑色素瘤术后辅助治疗以及BRAF V600E突变阳性NSCLC的治疗。Dabrafenib和Trametinib也已获全球60多个国家批准,分别作为单药疗法用于不可切除性或转移性BRAF V600突变阳性黑色素瘤的治疗。
今年6月底,Array BioPharma公司的靶向组合疗法Binimetinib(Braftovi,一种MEK抑制剂)+ Encorafenib(Mektovi,一种BRAF抑制剂)获美国FDA批准,用于BRAF V600E/K突变阳性不可切除性或转移性黑色素瘤患者的治疗,晚期BRAF突变黑色素瘤市场可能出现细分。
(编译 张莹)

ALESIA研究
Alectinib一线治疗ALK阳性肺癌显著降低疾病进展风险
同济大学附属上海市肺科医院周彩存教授在会上报告了靶向抗癌药Alectinib(Alecensa,艾乐替尼)治疗亚洲肺癌患者的Ⅲ期临床研究ALESIA(NCT02838420)结果。研究数据支持Alectinib作为标准用药,一线治疗新诊晚期间变性淋巴瘤激酶(ALK)阳性晚期或转移性非小细胞肺癌(NSCLC)患者。
该研究是一项多中心、开放标签、随机研究,在3个亚洲国家21个医疗中心入组187例初治ALK+晚期或转移性NSCLC患者,评估了Alectinib相对于辉瑞靶向抗癌药克唑替尼用于一线治疗的疗效和安全性,以及Alectinib的药代动力学。
结果显示,与克唑替尼相比,Alectinib使疾病进展或死亡风险显著降低78%(HR=0.22,95%CI 0.13-0.38)。研究者评估的Alectinib治疗组中位PFS尚未达到,克唑替尼组中位PFS为11.1个月。
虽然两组的中位OS尚未达到,但研究结果已证明,在亚洲晚期ALK阳性NSCLC患者中,无论有无CNS转移,Alectinib治疗患者预后均优于克唑替尼。与克唑替尼相比,Alectinib使CNS疾病进展风险显著降低86%(HR=0.14,95%CI 0.06-0.30)。
ALESIA是一项桥接研究,旨在显示与Ⅲ期ALEX研究结果的一致性,而不是证明Alectinib相对于Xalkori的优效性,研究数据进一步支持Alectinib用于ALK阳性NSCLC患者的治疗。ALESIA研究是Alectinib一线治疗ALK阳性肺癌疗效显著优于克唑替尼的第三项Ⅲ期临床研究。
有评论专家指出,ALEX、J-ALEX和ALESIA三项研究在剂量、人群和分层方面有差异,但结果类似,均证实了Alectinib可带来无进展生存改善,ALEX研究和ALESIA研究证实了Alectinib的中枢神经系统功效。
Alectinib是一种靶向ALK的新型小分子酪氨酸激酶抑制剂,迄今已在包括中国在内的全球65个国家获批,用于ALK阳性晚期NSCLC的一线治疗。多数ALK阳性NSCLC患者在接受当前标准治疗药物克唑替尼治疗一年内产生耐药性,约60%发生中枢神经系统(CNS)转移。研究显示,Alectinib能透过血脑屏障,在CNS中保持活性,因此针对脑转移瘤也有疗效。
(编译 王楠)
HDAC抑制剂治疗晚期激素受体阳性乳腺癌研究
会上,解放军第307医院江泽飞教授报告了组蛋白脱乙酰化酶(HDAC)抑制剂治疗晚期激素受体阳性乳腺癌的Ⅲ期研究。(摘要号 283O_PR)。
内分泌治疗是激素受体阳性乳腺癌治疗的根本。然而,内分泌治疗耐药非常普遍,进而导致疾病进展或复发。HDAC抑制剂作为一种表观遗传疗法,可在不改变DNA序列的情况下控制基因的表达与否。尽管有研究已经证实HDAC抑制剂可以逆转内分泌治疗耐药,但迄今为止尚无随机研究证实HDAC抑制剂治疗晚期乳腺癌优于现有内分泌治疗。
此项Ⅲ期研究探讨我国研发的HDAC抑制剂西达本胺治疗晚期激素受体阳性乳腺癌的疗效。研究从我国22个中心招募了365例绝经后激素受体阳性HER2阴性晚期乳腺癌患者。患者接受内分泌治疗(他莫昔芬和/或非甾体类芳香化酶抑制剂)后疾病进展,按2︰1比例随机分组,分别接受西达本胺(30 mg biw)联合依西美坦(25 mg qd)或安慰剂联合依西美坦治疗。
结果显示,西达本胺联合依西美坦组中位PFS为7.4个月,而安慰剂联合依西美坦组为3.8个月(HR=0.755, 95%CI 0.582~0.978,P=0.0336)。
江教授指出,这是Ⅲ期研究的第一阶段,旨在证实HDAC抑制剂联合内分泌阻滞剂与单独的内分泌阻滞剂相比,可以改善晚期激素受体阳性乳腺癌患者的无进展生存。
发生严重不良事件的患者在西达本胺组及安慰剂组中分别为51例(20.9%)和7例(5.8%)。这些事件包括中性粒细胞减少(50.8% vs 2.5%)、血小板减少(27.5% vs 2.5%)和白细胞减少(18.8% vs 2.5%)。没有人死于西达本胺。
有评论专家指出,这是第一项使用HDAC抑制剂在晚期乳腺癌中取得阳性结果的随机Ⅲ期研究。这表明该类型药物对于这些患者是有希望的,因为到目前唯一的阳性结果是针对早期乳腺癌的研究。这些研究发现应该会促使对晚期乳腺癌患者的HDAC抑制剂治疗开展更多的研究。
(编译 陈鹏 审校 王永胜)
JS001治疗神经内分泌肿瘤ⅠB期研究
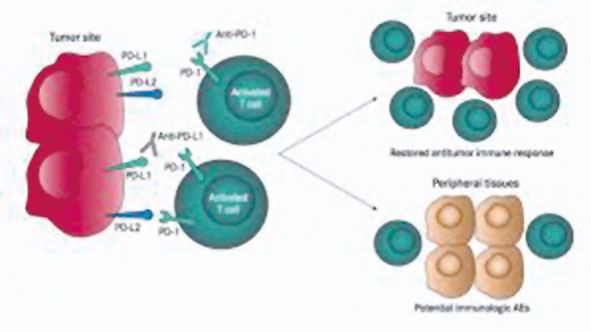
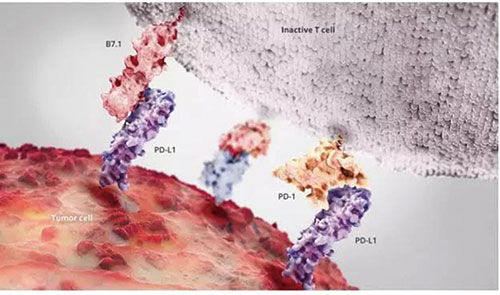
北京大学肿瘤医院沈琳教授团队在会上报告了神经内分泌肿瘤免疫疗法的ⅠB期研究,该研究提示,PD-1抗体JS001在经治进展期神经内分泌肿瘤患者中有明确的抗肿瘤活性和可控的安全性,肿瘤原发部位或为治疗有效性的影响因素,PD-L1阳性患者似接受JS001治疗更有效。JS001疗效值得进一步研究探讨。
目前对复发转移神经内分泌肿瘤的治疗选择较为有限,现有药物有效率较低。JS001是一种PD-1单克隆抗体,可有效阻断PD-1与PD-L1/PD-L2的相互作用。目前已有近20项针对JS001的临床研究在临床试验网站注册。今年的学术会议上陆续有JS001治疗黑色素瘤、鼻咽癌、食管癌、胃癌等肿瘤的研究公布,显示出良好的疗效。
该研究探讨了JS001在神经内分泌肿瘤的疗效,该研究为非随机开放ⅠB期研究,纳入标准治疗失败的进展期无功能性神经内分泌肿瘤患者,给予JS001治疗(3 mg/kg,2w)。共入组35例患者,30例接受了PD-L1检测,16例接受了微卫星不稳定性检测。
结果显示,影像学RECIST标准评估的PD-L1阳性患者的客观缓解率为50.0%,疾病控制率为50%,PD-L1阴性患者分别为10.0%和30.0%。免疫治疗相关评价标准irRECIST标准评估,PD-L1阳性患者ORR和DCR为60.0%,阴性患者分别为15.0%和35.0%。
安全性数据显示,JS001耐受性良好,大部分药物相关不良反应可控,无患者因不良反应退出或中断、减少用药。
(编译 王娜)
JS001治疗鼻咽癌Ⅱ期研究
中山大学附属肿瘤医院徐瑞华教授团队的JS001鼻咽癌Ⅱ期研究也在会上进行了公布。
标准治疗后肿瘤发生进展的转移性鼻咽癌患者,目前缺乏有效的治疗选择。有研究显示,鼻咽癌患者有PD-L1高表达且肿瘤浸润淋巴结,提示免疫疗法治疗鼻咽癌极具潜力。
JS001是一种重组人源性抗PD-1 IgG4抗体,可选择性阻断PD-1与其配体PD-L1和PD-L2的相互作用,促进抗原特异性T细胞活化。Ⅱ期研究旨在探讨JS001治疗鼻咽癌的疗效和安全性。
研究纳入难治、转移性鼻咽癌患者,给予JS001(3 mg/g,2周一周期)治疗直至肿瘤进展或出现不可耐受毒性反应。
2016年12月至2018年5月,共139例患者纳入研究,中位年龄46岁,84%为男性。截至2017年11月,84%的患者发生治疗相关不良反应,多为1~2级,包括发热(18.2%)、甲状腺功能减退症(18.2%)、蛋白尿(10.9%)、疲劳(9.1%)、总胆红素增加(9.1%),白细胞减少(9.1%)和贫血(7.3%)。14.5%的患者出现3级及以上的不良事件。
52例可评估患者中,16例患者疾病部分缓解(PR),客观缓解率(ORR)达30.8%;16例患者未发生进展,疾病控制率(DCR)达61.5%。其中,PD-L1阳性患者ORR达38.5%,DCR达65.4%。疾病缓解患者血清EBV DNA复制速率降低47倍。
该研究提示,PD-1单抗JS001在经治鼻咽癌患者中显示显著临床疗效和可控的安全性,血浆EBV DNA拷贝数或可作为接受免疫治疗鼻咽癌患者预后标志物。
(编译 华景和)


